Suplementação de glutamato e nucleotídeos na dieta acelera o turnover do carbono (δ13C) no músculo de leitões recém-desmamados
2 - UNESP/FMVZ/Botucatu
3 - UFMT
4 - UNESP/FMVZ/Botucatu
5 - UNESP/FMVZ/Botucatu
6 - UNESP/FMVZ/Botucatu
7 - UNESP/FMVZ/Botucatu
RESUMO -
O trabalho foi realizado com o objetivo avaliar os efeitos da adição de nucleotídeos e de glutamato em dietas de leitões recém-desmamados sobre a troca isotópica do carbono (δ13C) do músculo masseter. Os leitões (87 animais) foram desmamados com idade média de 21 dias e distribuídos em delineamento de blocos ao acaso em arranjo fatorial dos tratamentos 2 x 2 (dois níveis de nucleotídeos: 0,0 e 0,1% e, dois níveis de glutamato: 0,0 e 1,0% nas dietas). No início do experimento (dia 0), três leitões foram abatidos para avaliar o sinal isotópico dos tecidos que até então refletia o sinal isotópico do leite ingerido na maternidade. Nos dias 3, 6, 9, 14, 21, 35 e 49 após o desmame foram abatidos três leitões por tratamento para avaliar o sinal isotópico dos tecidos que refletia a mudança da dieta (ração a base de milho: C4 para ração a base de quirera de arroz: C3). As leituras de δ13C no músculo foram feitas por espectrometria de massas de razões isotópicas e os resultados dos dados isotópicos foram analisados pelo software OriginPro®8 através do ajuste de regressão não linear exponencial de primeira ordem. Os resultados de meia-vida (T50%) do turnover verificados para o masseter foram: T50% = 30,4 dias (ração com 0,1% de nucleotídeos), T50% = 30,27 dias (ração controle), T50% = 27,02 dias (ração com 1% de glutamato) e T50% = 25,94 dias (ração com a mistura dos aditivos), o que permitiu concluir que a mistura de aditivos (glutamato e nucleotídeos) nos níveis utilizados acelerou o turnover do carbon-13 no músculo masseter. No entanto, mais pesquisas são necessárias para avaliar a viabilidade econômica da inclusão dos aditivos estudados em dietas comerciais e seu período de oferta mais adequado.
Glutamate and nucleotides dietary supplementation speed up carbon turnover in weaning piglets muscle
ABSTRACT - The study aimed to evaluate the effects of nucleotides and glutamate on carbon turnover (δ13C) of weanling piglet’s masseter muscle. Eighty seven piglets weaned at 21-day-old were randomly assigned in a complete block design with a 2 x 2 fatorial arrangement of treatments (two levels of nucleotides: 0 and 0.1% and, two levels of glutamate: 0 and 1%). At the beginning of experimental period (day 0) three piglets were slaughtered (prior to the diet-switch) and, on days 3, 6, 9, 14, 21, 35 and, 49 after weaning, three piglets per treatment were slaughtered. The δ13C measurements were analysed by isotope-ratio mass spectrometry and, the isotopic values compared in accordance with the first order exponential equation by software package OriginPro®8. The turnover values verified for masseter muscle were: T50% = 30.4 days (0.1% nucleotide diet), T50% = 30.27 days (control diet), T50% = 27.02 days (1% glutamate diet) e T50% = 25.94 days (diet containing the mixture of additives). Thus, the additives’ mixture has accelerated the carbon turnover in masseter muscle. However, more researches are necessary to evaluate the economic feasibility of these additives in commercial diets, as such as, their better providing period.Introdução
Ao desmame, normalmente praticado com idade média de 21 dias, os leitões apresentam sistema digestório imaturo e, consequentemente, apresentam alterações nos padrões de secreções enzimáticas (pancreática e intestinal), assim como na taxa de crescimento de órgãos auxiliares da digestão até que estejam preparados para digerir eficientemente os ingredientes de origem vegetal presentes em sua nova dieta (KELLY; SMITH; Mc CRACKEN, 1991a, b). No animal jovem, as exigências por nutrientes são elevadas, em razão do suíno estar em pleno crescimento, o que reforça a necessidade por nutrientes mais digestíveis e aditivos que favoreçam seu desenvolvimento corporal, garantindo a expressão de seu potencial genético (deposição muscular) (MAKKINK et al., 1994). Além disso, diante das restrições à utilização de antibióticos promotores de crescimento na produção animal, a busca por alternativas tornou-se uma preocupação dos pesquisadores. Desse modo, o fornecimento de nutrientes que favoreçam o desenvolvimento dos órgãos e a imunocompetência dos leitões torna-se importante aliado na busca por melhores resultados zootécnicos (OLIVEIRA JR, 2008). Nesse aspecto, os nucleotídeos e o glutamato têm despertado interesse, pois além dos benefícios conhecidos sobre a manutenção da integridade intestinal, vêm demonstrando resultados satisfatórios sobre o desempenho de suínos jovens (Lackeyram et al., 2001; Burrin et al., 2008; Capalbo, 2013) e sobre a imunidade de leitões (CAMERON et al., 2001; DOMENEGHINI et al., 2004; SALOBIR et al., 2005; LEE et al., 2007; GODLEWSKI et al., 2009). No entanto, a abrangência dos benefícios relacionados à fisiologia do trato digestório (atuação no metabolismo lipídico e hepático), imunidade e desenvolvimento neurológico (Sánchez-Pozo et al., 1986; Ogoshi et al., 1988; Novak et al., 1994; Jin et al., 1996; Yamamoto et al., 1997; Newsholme et al., 2003) desses aditivos é restrito às pesquisas com ratos, camundongos e coelhos, já que o menor porte e o rápido ciclo produtivo permitem a obtenção de resultados em menor tempo de avaliação e com menor custo de manutenção desses animais em biotérios quando comparados com o exigido para a criação de suínos, o que torna o número de publicações que reportam os efeitos benéficos dos nucleotídeos e glutamato escasso na suinocultura. De forma geral, o glutamato é um aminoácido multifuncional que age como substrato essencial no metabolismo intermediário, sendo a sua forma livre muito importante nos tecidos e órgãos, especialmente músculo esquelético, cérebro, rins e fígado e, os nucleotídeos são importantes na disponibilização de bases nitrogenadas e nucleosídeos para tecidos e órgãos com síntese deficiente de nucleotídeos, além de beneficiar a taxa mitótica do intestino e fígado, favorecendo o seu desenvolvimento (GIACOMETTI, 1979; DOMENEGHINI et al., 2004). Para avaliar a maneira como esses nutrientes são incorporados aos tecidos animais utiliza-se a técnica de isótopos estáveis como traçadores naturais. Esta técnica é indicada em situações em que fontes dietéticas isotopicamente distintas estão disponíveis para os animais, uma vez que a composição isotópica dos tecidos e fluídos dos animais depende principalmente da alimentação (Kennedy e Krouse, 1990), assim, dietas com assinaturas isotópicas distintas podem ser usadas para medir taxas de turnover (troca isotópica) em todo o corpo do animal. Dessa forma, após a troca da dieta do animal, que possui assinatura isotópica diferente da anterior, ocorre mudança na composição isotópica do tecido, a qual é dependente da velocidade com que os constituintes são incorporados pelo organismo que, por sua vez, sofre variação em função da atividade metabólica de cada tecido (HOBSON e CLARK, 1992). Neste contexto, o presente trabalho foi conduzido com objetivo de avaliar os efeitos da adição de nucleotídeos e glutamato nas rações de leitões recém-desmamados sobre a troca isotópica do carbono (δ13C) do músculo Masseter.Revisão Bibliográfica
Ação dos nucleotídeos Nucleotídeos são moléculas de estrutura diversificada, compostos por uma base nitrogenada, um açúcar pentose e, um ou mais grupos fosfatos. O açúcar pentose pode ser ribose (ácido ribonucléico - RNA) ou 2-desoxirribose (ácido desoxirribonucléico - DNA) e, as bases nitrogenadas podem ser purinas ou pirimidinas (Rudolph, 1994). Quando o grupo fosfato encontra-se ausente, o composto é denominado “nucleosídeo”, o qual é formado pela combinação da pentose e base nitrogenada através de ligações glicosídicas (RIEGEL, 2002). Os nucleotídeos são importantes para o funcionamento do organismo, pois participam de vários processos bioquímicos, atuando como precursores de ácidos nucléicos, reguladores fisiológicos (AMP, GMP), fonte de energia (ATP e GTP) e co-enzimas (FAD, NAD e CoA) (LERNER e SHAMIR, 2000; NELSON e COX, 2006). Nutricionalmente, os nucleotídeos não são considerados essenciais, pois podem ser sintetizados pelo organismo a partir da via de síntese “de novo”, processo que ocorre no citossol dos hepatócitos. Neste processo, as bases púricas são sintetizadas a partir da glicina, glutamina, aspartato e CO2 e, as bases pirimídicas a partir do aspartato, glutamina, NH3 e CO2 ou ainda, pela via “de salvamento”, que utiliza nucleosídeos e bases resultantes da quebra dos nucleotídeos para resíntese dos ácidos nucléicos (MATEO et al., 2004). A via de síntese “de novo” na mucosa intestinal não é ativada, segundo estudos conduzidos por Savaiano e Clifford (1981) e LeLekeiko et al. (1983), apesar da alta taxa de turnover celular, de modo que a mucosa intestinal é dependente inevitavelmente da via “de salvamento” e os nucleotídeos dietéticos representam a fonte mais importante para esta via. A via síntese “de novo” é um processo considerado metabolicamente caro por exigir gasto significante de energia na forma de ATP (YAMAMOTO et al., 1997). A via “de salvamento” pode poupar energia e permite que células que têm a capacidade limitada (LeLeiko et al., 1983) ou ausente (Mackinnon e Deller, 1973; Savaiano e Clifford, 1981) de síntese “de novo” (eritrócitos, leucócitos, enterócitos, células da medula óssea e linfócitos) possam manter os pools de nucleotídeos (Sanderson e He, 1994). A síntese de novo de nucleosídeos e nucleotídeos pode não ser adequada em períodos de deficiência protéica associada à infecção, consumo limitado de nutrientes (deficiência) ou distúrbio endógeno, uma vez que a energia e os aminoácidos necessários para a realização da síntese “de novo” estão escassos. Por isso, nessas situações, a via “de salvamento” passa a ter maior importância (RUDOLPH, 1994; YAMAUCHI et al., 1998). Importância dos nucleotídeos na dieta Os nucleotídeos provenientes da dieta são importantes para tornar disponíveis as bases e nucleosídeos que podem ser utilizados imediatamente na síntese de nucleotídeos pela via “de salvamento”. Essa via é extremamente importante para os tecidos e órgãos cuja síntese de nucleotídeos é deficiente, mas que apresentam uma rápida divisão mitótica, como cérebro, eritrócitos, medula óssea, mucosa intestinal e linfócitos, uma vez que nestes tecidos há grande demanda por ácidos nucléicos para atender a rápida divisão mitótica (Westwood, 1999). As células de rápido crescimento apresentam capacidade limitada (LeLeiko et al., 1983) ou mesmo ausente (MacKinnon e Deller, 1973; Savaiano e Clifford, 1981) para síntese de purinas e pirimidinas pela síntese “de novo”, tornando necessária a suplementação exógena para manter o pool de nucleotídeos (UAUY et al., 1990; CARVER e WALKER, 1995). Neste contexto, tem sido relatado em humanos e animais, o efeito positivo da adição de nucleotídeos na dieta para o desenvolvimento neurológico e do trato gastrointestinal (divisão e crescimento celular), ativação do sistema imunológico (maturação, ativação e proliferação dos linfócitos, expressão de imunoglobulinas e algumas citocinas) e, manutenção da saúde intestinal (estímulo para crescimento da microflora intestinal benéfica), auxiliando a redução da incidência de doenças entéricas (YU, 1998; RODWELL, 2000; CARLSON e VEUM, 2001). Outros estudos ainda observaram efeitos benéficos dos nucleotídeos sobre o desenvolvimento corporal e neurológico que foi acelerado quando suplementos a base de nucleotídeos foram fornecidos à recém-nascidos que sofreram retardo no crescimento intra-uterino (Cosgrove; Davies; Jenkins, 1996; Boza, 1998); sobre o aumento da concentração de fosfatidilcolina e da proporção fosfatidilcolina:fosfatidiletanolamina no córtex cerebral de ratos alimentados com dietas contendo nucleotídeos em comparação com os que receberam uma dieta isenta desse aditivo (Sato et al., 1995); sobre o aumento na capacidade de aprendizado em ratos que consumiram dietas com nucleotídeos (Sato et al., 1995); sobre a melhora na memória de camundongos com deficiência mental quando receberam dieta a base de nucleosídeos e nucleotídeos (Yamamoto et al., 1997), indicando que os nucleotídeos provenientes da dieta podem ser importantes para a função do sistema nervoso e para o cérebro, de forma global. Como o período pós-desmame para o leitão é crítico, uma vez que nessa fase a necessidade por nucleotídeos é maior, mas a disponibilidade dos precursores necessários para sua síntese (energia e glutamina) encontra-se reduzida (Rodwell, 2000; Rossi et al., 2007), a adição de nucleotídeos nas dietas de leitões pós-desmame seria necessária para a manutenção da integridade do trato gastrointestinal, uma vez que estudos demonstraram que 2% a 5% dos nucleotídeos da dieta são retidos no intestino delgado, fígado e tecido muscular esquelético (Savaiano e Clifford, 1978; Uauy, 1994) e, ainda que essa retenção apresenta-se em níveis aumentados em animais jovens e que se enquadram em quadros fisiológicos específicos como rápido crescimento, baixa imunocompetência ou sujeitos à estressores, características comuns à fase pós-desmame dos leitões (KOBOTA, 1969; GROSS e SAVAIANO, 1991; MATEO, 2005). Então, nessa fase pós-desmame, a suplementação de nucleotídeos por meio da dieta poderia apresentar efeito promotor de crescimento e/ou de melhoria da saúde de leitões recém-desmamados. No entanto, as informações a respeito da ação dos nucleotídeos no desenvolvimento imunológico e gastrointestinal de animais jovens são escassas, assim como os estudos conduzidos com suínos nessa fase. Ação do glutamato O glutamato é um aminoácido não essencial que atua como fonte de energia para o intestino. Além disso, é importante precursor de outras moléculas biologicamente ativas, como glutamina, glutationa, prolina, arginina, sendo também o maior neurotransmissor excitatório do sistema nervoso de mamíferos (LIU et al., 2002; BURRIN et al., 2008). É um aminoácido multifuncional que age como substrato essencial no metabolismo intermediário, sendo a sua forma livre muito importante nos tecidos e órgãos, especialmente músculo esquelético, cérebro, rins e fígado (GIACOMETTI, 1979). Estudos demonstraram que o glutamato é oxidado quase que totalmente (90%) a CO2 nos enterócitos de leitões de 24 dias de idade, sendo este seu principal destino metabólico e que, o glutamato entérico e não o glutamato derivado da glutamina é a fonte preferencial para a síntese de glutationa na mucosa intestinal, além disso, é considerado o principal precursor da síntese de prolina no trato gastrointestinal, sendo responsável por aproximadamente 40% do acúmulo diário de prolina corporal em leitões com duas semanas de idade (MURPHY et al., 1996; REEDS et al., 1997; REEDS et al., 2000; BURRIN et al., 2008). O glutamato também tem ação na modulação da secreção gástrica (por ativação dos receptores ionotrópicos), no controle da função digestória (estímulo do nervo vagal aferente gástrico) e, no comportamento ingestivo (BURRIN et al., 2008; BURRIN e STOLL, 2009). Observaram-se ainda efeitos do glutamato (Glu) sobre a função gástrica (absorção e transporte de Glu por via estomacal), ativação do nervo vago aferente no intestino (induzindo à preferência condicionada por sabores e estímulo ao apetite), estímulo às contrações da região fúndica estomacal (pela via colinérgica neuronal), influência na melhoria do estado emocional, no aprendizado e memória (PLATT, 2007; TSURUGIZAWA e TORII, 2010). Importância do glutamato na dieta O glutamato possui papel central na quantidade diária de proteína que é descartada pelo organismo. Os motivos pelos quais ele apresenta papel no metabolismo de proteínas podem ser sumarizados por sua atuação versátil em três rotas bioquímicas. A primeira, pela inter-relação da “família do glutamato” (representados pelos seguintes aminoácidos: glutamato, glutamina, prolina, histidina, arginina e ornitina), onde esses aminoácidos por representarem 25% do consumo de aminoácidos via dieta, serão metabolicamente degradados/reciclados através de sua conversão em glutamato (BROSNAN, 1998). A segunda rota refere-se à importância do glutamato como integrante do sistema catalítico de transaminação que envolve a atuação da glutamato-desidrogenase em associação com as glutamato-aminotransferases na remoção do grupamento alfa-amínico de quase todos os aminoácidos. E a terceira rota baseia-se no papel central do glutamato como substrato para a síntese de N-acetilglutamato, um ativador alostérico da carbamil-fosfato-sintase I, que é a principal enzima do ciclo da uréia, responsável por assegurar que a taxa de uréia produzida esteja de acordo com as taxas de desaminação dos aminoácidos. Portanto, além da importância do glutamato no metabolismo protéico, ele indiretamente exerce papel regulatório da função renal (BROSNAN, 1998). Observou-se ainda a atuação do glutamato na fisiologia intestinal. A adição de ácido glutâmico nas dietas de leitões pós-desmame é de grande importância para a manutenção do trato gastrointestinal, uma vez que estudos demonstraram que o glutamato após ser catabolizado, libera energia ou é utilizado como substrato para síntese de outros aminoácidos não-essenciais pela mucosa intestinal de leitões recém-desmamados (REEDS et al., 1996; REEDS et al., 1997). Concluiu-se ainda que em comparação com dieta a base de milho, farelo de soja e soro de leite, o fornecimento de dieta suplementada com 1% de glutamato para leitões desmamados com 28 dias de idade, melhorou a capacidade de absorção de D-xilose pelo intestino delgado no 7° e 14° dia pós-desmame e resultou em maior altura das vilosidades do jejuno no 14° após o desmame e maior concentração de RNA no músculo esquelético no 7° dia pós-desmame (LIU et al., 2002). Além disso, o estudo preliminar de Araya et al. (2013) verificou a existência de um novo mecanismo para a secreção e concentração de glutamato no suco pancreático, bem como na reciclagem de aminoácidos neutros (a exemplo da glutamina e alanina) e do glutamato entre o pâncreas (que absorve aminoácidos para a síntese de enzimas do suco pancreático) e o intestino delgado. Ainda confirmou a importância da liberação de aminoácidos através do suco pancreático na manutenção da homeostase do intestino delgado, quando não há fornecimento de proteína na dieta. Isótopos estáveis do carbono Os isótopos são átomos do mesmo elemento químico, mas que apresentam diferentes números de nêutrons e massa. Os isótopos podem ter núcleos instáveis ou estáveis. Os isótopos de núcleos instáveis são também chamados de radioativos, sofrem desintegração espontânea por emissão de partículas nucleares ou radiação eletromagnética e geram os isótopos radiogênicos. Em contrapartida, os isótopos de núcleos estáveis não se desintegram por nenhum processo conhecido e são isótopos de elementos em abundância e de ocorrência natural na biosfera, como o hidrogênio (H), carbono (C), nitrogênio (N), oxigênio (O) e enxofre (S), principais elementos dos ciclos hidrológico, geológico e biológico (CLARK e FRITZ, 1997). Cada elemento apresenta um isótopo estável leve dominante: carbono-12 (12C), hidrogênio-1 (1H), oxigênio-16 (16O), nitrogênio-14 (14N) e ainda, um ou dois isótopos estáveis pesados: carbono-13 (13C), hidrogênio-2 (2H), oxigênio-17 (17O), oxigênio-18 (18O) e nitrogênio-15 (15N), com abundância ou concentração natural expressa em átomos %. Essa abundância natural para os isótopos estáveis de carbono é de aproximadamente 98,89 átomos % para o 12C e 1,11 átomos %, para o 13C (KENNEDY e KROUSE, 1990; DUCATTI, 2007). As plantas, na sua maioria, podem ser classificadas em dois grupos principais, de acordo com a via fotossintética de fixação do CO2: ciclo fotossintético C3 e ciclo fotossintético C4. Nestas plantas, o primeiro composto orgânico a ser sintetizado é um ácido carboxílico que nas plantas de ciclo C3, possui três átomos de carbono e nas plantas de ciclo C4 possui quatro átomos de carbono (DeNIRO e EPSTEIN, 1981). A via fotossintética C3 ocorre na maioria das dicotiledôneas, como árvores, arbustos, soja, arroz, trigo, cevada e algodão, sendo a via fotossintética C4 encontrada no milho, cana de açúcar, sorgo e outras forrageiras de origem tropical ou subtropical. O CO2 atmosférico possui o valor de δ13C de aproximadamente -7,7‰, sendo classificado como fonte primária de carbono para as plantas terrestres. Este carbono sofre discriminação isotópica ao longo do processo de fotossíntese, ocorrendo diminuição da concentração em 13C e aumento da concentração em 12C (KENNEDY e KROUSE, 1990). Durante a assimilação fotossintética, as plantas do ciclo fotossintético C3 fixam o CO2 atmosférico através do ciclo de Calvin-Benson e apresentam valores de δ13C entre -22‰ e -34‰ (valor modal de -28‰), enquanto que as plantas do ciclo fotossintético C4 fixam o CO2 atmosférico através do ciclo de Hatch-Slack e apresentam valores de δ13C entre -9‰ e -16‰ (valor modal de -14‰). O sinal negativo indica que a planta ou seu subproduto apresenta menor concentração em 13C que o padrão internacional (PDB: rocha carbonatada da formação Pee Dee da Carolina do Sul, EUA). Portanto, as plantas C3 e C4 apresentam assinaturas isotópicas diferentes, devido ao fracionamento que ocorre durante a fixação fotossintética do carbono (DeNIRO e EPSTEIN, 1981). Considerando a existência da diferença isotópica da ordem de +14‰ mais rico em 13C nas plantas do ciclo fotossintético C4 em relação às do ciclo fotossintético C3, torna-se possível a utilização destas plantas e seus subprodutos como marcadores naturais em animais, sem a necessidade de sintetizar compostos especificamente marcados (DUCATTI, 2007). A mensuração da relação entre isótopos é realizada pelo espectrômetro de massas de razões isotópicas, que analisa a concentração dos diferentes isótopos do elemento, admitido no sistema sob a forma gasosa (H2, CO2, N2 e SO2). Os valores do delta per mil (δ‰) do carbono-13 são expressos com base no padrão internacional Pee Dee Belemnite (PDB), carbonato sólido de belemnitela americana, da formação rochosa Pee Dee da Carolina do Sul, Estados Unidos, aceito universalmente na comparação das composições isotópicas do carbono (VOGEL, 1993). O método do traçador isotópico: a diluição isotópica A grande importância do método do traçador é que os isótopos de um dado elemento, quer seja radioativo ou estável, podem ser identificados em uma mistura normal dos isótopos deste elemento, conforme o mesmo é encontrado na natureza, possibilitando o acompanhamento do elemento nos diferentes compartimentos do sistema em estudo, de maneira qualitativa e quantitativa (WOLFE, 1992). O método do traçador isotópico, segundo Wolf (1969), é usado de três maneiras: (I) para obter evidências da síntese (incorporação) e relações precursor - produto entre compostos conhecidos; (II) no isolamento, purificação e identificação de intermediários desconhecidos em uma cadeia de reações; (III) como ferramenta analítica no acompanhamento do curso de uma reação, de compostos conhecidos. Nessa classificação, temos (I) e (II) referindo-se ao uso da técnica, em um aspecto qualitativo e (III), referindo-se à técnica analítica por diluição isotópica, ou seja, assumindo um caráter quantitativo. Um exemplo clássico do uso da técnica de traçador na identificação de intermediários desconhecidos em cadeias de reações refere-se aos trabalhos de Calvin e colaboradores em estudo da fixação do CO2 no processo da fotossíntese, onde o emprego do CO2 marcado com 14C em ensaios com algas expostas à luz permitiu a identificação de compostos estáveis derivados da assimilação do 14CO2, elucidando o ciclo da redução do carbono, também chamado ciclo de Calvin-Benson, um dos mais bem estudados no processo fotossintético (SMITH e EPSTEIN, 1971). O método do traçador isotópico tem sido empregado associado às técnicas químicas e bioquímicas: como a fotografia (autorradiografia) e cromatografia, bem como aos estudos de nutrição animal. A técnica dos isótopos estáveis do carbono é particularmente apropriada para determinar a contribuição relativa de duas fontes isotopicamente distintas de matéria orgânica da dieta animal, além de fornecer informação do tempo de integração do alimento assimilado e não somente daquele ingerido (TIESZEN et al., 1983). Um exemplo envolvendo o uso de isótopos estáveis de carbono na nutrição animal envolve o estudo da seletividade de plantas forrageiras por animais de produção através de medidas de δ13C nas fezes, a exemplo da determinação da proporção de leguminosa (C3) e gramínea (C4) na dieta de herbívoros como a realizada por Caswell et al. (1973). Outros estudos, embora em menor número, envolvem o balanço e destino dos nutrientes em tecidos animais realizados com emprego de moléculas enriquecidas isotopicamente, a exemplo de aminoácidos-15N, metionina-13C, uréia-13C (SMITH et al., 1992; WATT; CORBETT; RENNIE, 1992). Assim, os isótopos de carbono apresentam-se como alternativa promissora para estudar processos relacionados à digestão e metabolismo de nutrientes, por estarem presentes em todos os nutrientes capazes de gerar energia aos animais e por apresentarem cerca de 50% dos elementos químicos que compõem o corpo dos animais (RENNIE, 1999). Turnover Nas últimas décadas os isótopos estáveis têm sido aplicados de forma crescente e contínua em pesquisas na área de ciências agrárias como alternativa promissora para estudar processos relacionados à digestão, absorção e metabolismo de nutrientes em humanos e animais, assim como, para fins de rastreabilidade e certificação do padrão dietético dos animais (GANNES et al., 1998). Assim, uma vez que os tecidos corporais refletem o sinal isotópico das dietas que os animais consomem, a análise da variação natural da abundância dos isótopos estáveis representa uma ferramenta poderosa para as pesquisas, por ocasião de uma eventual substituição de dieta contendo ingrediente de origem animal por dieta estritamente vegetal e vice-versa (PEARSON et al., 2003; CALDARA et al., 2008). Nesse contexto, o estudo do turnover (troca isotópica) dos órgãos e tecidos é fundamental para determinar como a assinatura isotópica da dieta de um animal é incorporada e ainda, demonstrar como a taxa de turnover de um tecido está relacionada com sua taxa metabólica (HOBSON e CLARK, 1992; THOMPSON et al., 1998). De modo geral, tecidos com rápido turnover refletirão dietas mais recentes, pois serão mais ativos metabolicamente, enquanto aqueles com taxas de turnover mais lentas refletirão dietas de períodos anteriores e serão, portanto, tecidos menos ativos metabolicamente (HOBSON e CLARK, 1992; CALDARA et al., 2007; CALDARA et al., 2010).Materiais e Métodos
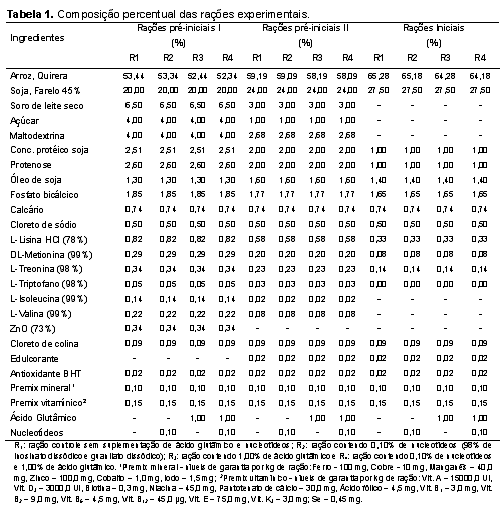
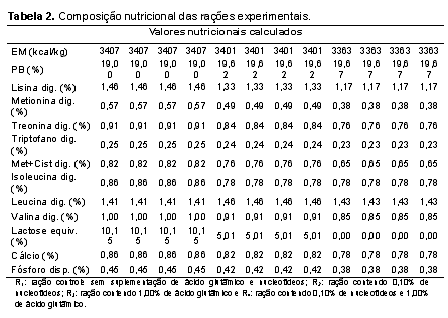
O experimento foi conduzido na Universidade Estadual Paulista, Faculdade de Medicina Veterinária e Zootecnia, câmpus de Botucatu, onde 87 leitões machos castrados e fêmeas de linhagem comercial, desmamados com idade média de 21 dias foram alojados em sala de creche construída em alvenaria, em baias metálicas suspensas com piso parcialmente ripado de 1,0 de largura x 1,75 m de comprimento, equipadas com comedouros e bebedouros tipo chupeta. O controle da temperatura interna da sala de creche foi realizado com a regulagem das cortinas laterais e com o manejo das campânulas de aquecimento instaladas em cada baia. A principal fonte energética das dietas experimentais foi a quirera de arroz, matéria-prima oriunda de planta do ciclo fotossintético C3, de forma que as dietas apresentassem sinais isotópicos de 13C distintos das dietas fornecidas aos leitões lactentes e às matrizes na granja que, desde a cobertura até o desmame receberam rações cuja fonte energética principal era o milho, planta de ciclo fotossintético C4. O procedimento de alterar a razão isotópica das dietas fornecidas aos leitões após o desmame em relação àquelas fornecidas às matrizes em gestação, lactação e aos leitões lactentes teve por objetivo possibilitar a avaliação da velocidade com que ocorre alteração na razão isotópica nos tecidos corporais dos leitões depois de serem desmamados. Os leitões foram alimentados à vontade e submetidos ao programa de alimentação por fases, de modo a atender às exigências nutricionais mínimas, de acordo com Rostagno et al. (2011), nas seguintes fases: pré-inicial I (21 aos 35 dias de idade), pré-inicial II (36 aos 50 dias de idade) e inicial (51 aos 70 dias de idade). O grupo de 87 leitões foi distribuído em delineamento experimental de blocos ao acaso, com arranjo fatorial dos tratamentos 2 x 2 (dois níveis de nucleotídeos: 0% e 0,1% e, dois níveis de ácido glutâmico: 0% e 1,0%). A fonte de nucleotídeos utilizada apresentava 98% de grau de pureza, sendo constituída por guanilato dissódico e inosinato dissódico. As composições percentual e nutricional das dietas pré-iniciais e iniciais estão apresentadas nas Tabelas 1 e 2, respectivamente. A adoção dos níveis de nucleotídeos baseou-se em estudos preliminares (Donald; Carver; Barness, 1993; Amorim, 2012), os quais possibilitaram verificar seus efeitos benéficos em situações comuns à fase considerada neste estudo, ou seja, onde os animais são imunocompetentes, estão em crescimento (possuem tecidos em rápido desenvolvimento) e sujeitos à fatores estressantes (Carver, 1994; Uauy, 1994; Grimble e Westwood, 2001; Yao et al., 2013) e, em estudo onde o ácido glutâmico demonstrou efeitos na aceleração do turnover em órgãos de leitões (AMORIM, 2012). Nos dias 3, 6, 9, 14, 21, 35 e 49 depois do desmame, três leitões por tratamento foram sacrificados, após eletronarcose. No dia do desmame (dia 0 do período experimental), três leitões também foram abatidos com o objetivo de expressar a composição isotópica dos tecidos que até o momento do desmame refletia a composição isotópica das dietas fornecidas às matrizes e leitões antes do desmame, cujo sinal isotópico era o C4. Após a insensibilização elétrica e sangria por meio de incisão na veia jugular, amostras do músculo masseter (composto em sua maioria por fibras musculares de contração rápida e metabolismo glicolítico) foram coletadas, lavadas com água deionizada (para remoção de resíduos de sangue nos tecidos), acondicionadas em frascos plásticos identificados e, imediatamente congeladas (-18ºC) até a sua preparação para as análises isotópicas. Para a realização das análises isotópicas, as amostras foram descongeladas e submetidas à secagem em estufa de ventilação forçada (modelo MA-035/5, Marconi, Piracicaba, Brasil) a 50oC por um período de 48 horas. Após a secagem, as amostras foram desengorduradas com éter etílico P.A., em aparelho Soxhlet (modelo TE-044, Tecnal, Piracicaba, Brasil), em temperatura média de 65ºC durante 4 horas, uma vez que a fração lipídica pode ocasionar fracionamento isotópico de até 5‰ nos valores de δ13C (Piasentier et al., 2003). Em seguida, foram submetidas à nova secagem em estufa de ventilação forçada a 50ºC durante meia hora, para evaporação do éter residual. Posteriormente, os ingredientes, as rações e amostras do músculo foram moídas em moinho criogênico à -196oC (modelo 2010, SPEX SamplePrep Geno/Grinder, Metuchen, USA), conforme otimizações (de tempo e rotação) específicas, as quais estão apresentadas na Tabela 3. Cada programa de moagem foi otimizado de forma a obter material homogêneo com granulometria ≤60 μm, com objetivo principal de evitar problemas de repetibilidade nas análises isotópicas. Em seguida, essas amostras foram pesadas (50 a 70 μg) em cápsulas de estanho, as quais foram posteriormente introduzidas por meio de amostrador automático (modelo AS-3000, Thermo Fisher Scientific, Waltham, MA, USA) no analisador elementar (modelo Flash 2000 CHNS/O, Thermo Fisher Scientific, Waltham, MA, USA), no qual em presença de oxigênio, a amostra foi queimada quantitativamente para a obtenção de CO2, ou seja, para obtenção das seguintes combinações isotópicas gasosas e suas respectivas relações massa/carga: 12C + 16O + 16O = 44; 13C + 16O + 16O = 45 e 13C + 16O + 16O = 46. Os gases formados foram separados em coluna cromatográfica gasosa (PN 26008205, Thermo Scientific, Alemanha) mantida a 45°C e analisados em espectrômetro de massas de razões isotópicas (IRMS Delta V Advantage, Thermo Fisher Scientific, Waltham, MA, USA) interligado ao software para processamento dos dados Isodat, versão 3.0 (Thermo Fisher Scientific, Alemanha), no centro de Isótopos Estáveis Ambientais do Instituto de Biociências da UNESP, câmpus Botucatu. Para o controle interno de qualidade das análises, durante cada meia série de determinações (ou seja, no início e final de cada sequência de análise de 45 amostras) um padrão interno foi utilizado para assegurar a acurácia e precisão das quantificações. O padrão interno consistiu em um carvão mineral proveniente de eucalipto, o qual foi analisado e aferido contra o padrão de trabalho (IVA). O sinal médio de δ13C obtido após análises em triplicata desse carvão mineral foi de -28‰ ± 0,2‰. Já o padrão de referência utilizado em intervalos de 6 meses para assegurar a aferição do espectrômetro foi o IVA-33802174 (Ingenieur und Vertriebsbüro für Analysentechnik, certificate number: 147273, Meerbusch, Alemanha), que consistia em uma uréia certificada e aferida contra o padrão primário internacional (o PDB – Pee Dee Belemnitela), cujas reservas dessa rocha atualmente esgotaram-se (Long, 1995) e, cujo sinal médio de δ13C obtido após análises em triplicata desse padrão foi -39,73‰ ± 0,2‰. Os resultados das análises por IRMS foram expressos em notação delta per mil (δ‰13C) em relação ao padrão internacional Pee Dee Belemnitela (PDB), com erro de análise da ordem de 0,2‰, utilizando a seguinte equação: δ13C(amostra, padrão) = {[(13C/12C)amostra - (13C/12C)padrão] / (13C/12C)padrão} x 1000 δ13C(amostra, padrão) = [(Ramostra - Rpadrão) / Rpadrão] x 1000, onde: δ13C = enriquecimento do isótopo mais pesado 13C/12C da amostra em relação ao padrão internacional; expresso em ‰ R = razão isotópica entre o isótopo menos e mais abundante (13C/12C); adimensional. Para avaliar a velocidade de substituição do carbono nas amostras foi empregada a equação exponencial em função do tempo, segundo Bearhop et al. (2002): δ‰13C(tecido) = a + b0 e-kt , onde: a = concentração isotópica no tecido, exclusivamente do metabolismo da fonte B; b0 = representa a magnitude da alteração isotópica do tecido, dada pela diferença entre a concentração isotópica no tecido antes (Fonte A) e após a troca da dieta (Fonte B); k = constante (taxa de turnover do carbono), expressa em dias-1; t = tempo, expresso em dias. De acordo com o modelo teórico proposto por Ducatti et al. (2002), essa equação exponencial pode ser melhor representada pela seguinte equação que considera a administração (uma de cada vez) de somente duas fontes naturais que sejam isotopicamente distintas entre si: δ13C(t) = δ13C(f) + [δ13C(i) - δ13C(f)] e-kt, onde: δ13C(t) = enriquecimento isotópico do tecido em qualquer tempo (t); δ13C(f) = enriquecimento isotópico do tecido, no patamar de equilíbrio ou condição final; δ13C(i) = enriquecimento isotópico do tecido, na condição inicial, antes da troca das dietas; k = constante de troca (turnover), em unidades de tempo; t = tempo (em dias) desde a substituição da ração. Nesta condição, admitiu-se também que a Fonte A (C4) deixou de ser administrada fisicamente aos leitões de maneira que, à medida que o tempo de experimento evoluiu, a concentração dos isotópos no tecido do animal começou a ser substituída exponencialmente pelos isótopos estáveis da Fonte B (C3). O tempo total (tn%) necessário para que ocorresse a substituição dos átomos iniciais pelos átomos finais no tecido foi determinado pela equação a seguir (DUCATTI, 2007): tn% = (-1 / k) ln (1 - F), onde: tn% = n% de substituição dos átomos iniciais pelos finais, expresso em dias; k = constante de turnover, expressa em dias-1; ln = logaritmo neperiano; F = fração de átomos trocados, que pode variar de 0,00 a 0,95, sendo calculada pela seguinte equação: F = 1 - e-kt, em que: k = constante de turnover, expressa em dias-1; t = tempo de troca do carbono, neste caso, t = 49 dias de experimentação. Isso significa dizer que, quando F = 0,50, há 50% de troca isotópica, ou seja, obtêm-se o valor de meia-vida, que fornece a estimativa de velocidade no processo de troca dos isótopos nos tecidos ou órgãos. Dessa forma, a equação da meia-vida nos permite inferir que tecidos que forneçam valores de meia-vida menores, apresentarão “alta velocidade” de metabolização ou incorporação dos isótopos estáveis, sendo o inverso também verdadeiro. Em contrapartida, quando F = 0,95, há 95% de troca total, ou seja, a troca isotópica foi estabilizada, o que também significa dizer que o tecido atingiu seu patamar de equilíbrio de substituição isotópico (DUCATTI et al., 2002). O cálculo do patamar de equilíbrio de substituição isotópico reflete a confiabilidade no cálculo da meia-vida por fornecer subsídios aos pesquisadores avaliarem se o período experimental foi suficiente para que ocorresse a troca dos carbonos do tecido avaliado pelos carbonos da nova dieta. Dessa maneira, os pesquisadores podem utilizar o parâmetro meia-vida para a comparação de seus tratamentos. Os dados de enriquecimento isotópico relativo (δ‰13C) do músculo provenientes das análises por IRMS foram compilados versus cada tempo de abate ao longo dos 49 dias de experimentação. Posteriormente, cada conjunto de dados (dia de abate, δ‰13C de cada músculo de cada leitão) foi ajustado pelo método de equações de regressão não-lineares de primeira ordem (Bates e Watts, 1988) fornecendo curvas isotópicas exponenciais a partir do software OriginPro®8, versão: 8.07 (OriginLab Corporation, Northampton, Estados Unidos, 2007) para posteriores cálculos e comparações entre valores de meia-vida (T50%) e t95% dos tratamentos.Resultados e Discussão
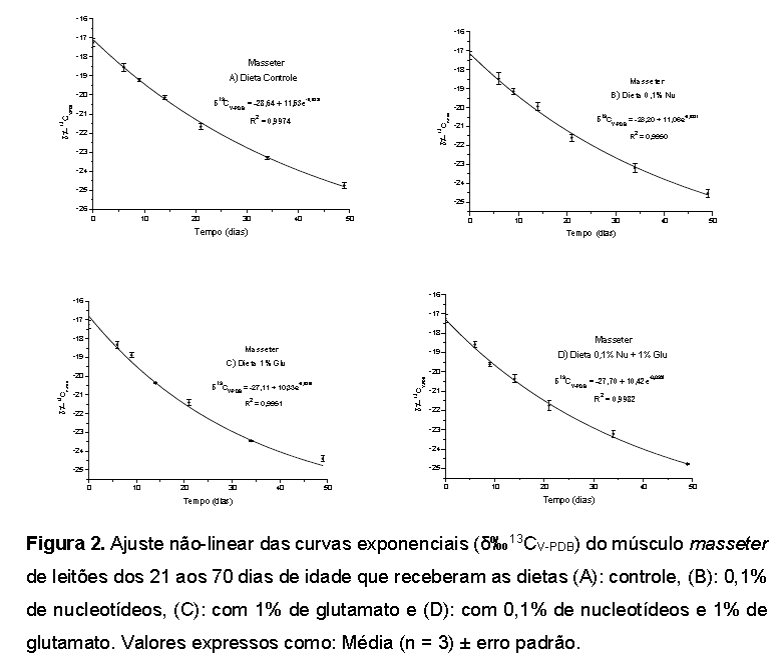
Composição isotópica das dietas A dieta de lactação fornecida às porcas em lactação, bem como aos leitões lactentes, refletiu a assinatura isotópica característica de plantas C4, apresentando valor médio de δ13C -16,15‰, uma vez que o componente principal da dieta era o milho, planta C4, cujo valor médio analisado foi δ13C -17,40‰. Com base na régua isotópica fornecida na Figura 1, podemos observar que as plantas C4 assimilam mais carbono-13 do que carbono-12 durante a fotossíntese e, essa preferência pelas moléculas de 13CO2 as tornam isotopicamente mais pesadas, uma vez que incorporam δ13C +14‰ do que as plantas C3. Em contrapartida, as plantas C3 incorporam mais carbono-12 do que carbono-13 desde o estágio inicial da fotossíntese até a formação dos compostos finais de carbono e, essa predileção pelas moléculas de 12CO2 as tornam mais leves isotopicamente. Os resultados das análises isotópicas das dietas experimentais (ração controle: -27,59‰; ração com 1% de glutamato: -27,40‰, ração com 0,1% de nucleotídeos: -27,86‰ e ração com a mistura dos aditivos: -27,57‰), demonstram que o sinal isotópico das dietas manteve-se ao redor de δ13C -27‰ e que, conforme o esperado, refletiram a assinatura isotópica da quirera de arroz, planta C3, cujo valor médio analisado foi de δ13C -30,14‰, indicando a alteração isotópica em função da composição das dietas fornecidas aos animais (Smith e Epstein, 1971), bem como discriminação isotópica entre os cereais (milho x quirera de arroz) (Park e Epstein, 1961), nos permitindo afirmar que os princípios da diluição isotópica (Jones et al., 1979; Tiezen et al., 1983; Hobson e Clark, 1992) foram seguidos no presente experimento. Avaliação do δ‰13CV-PDB do músculo masseter de leitões Na Tabela 4 são apresentados os valores de meia-vida (T50%) e substituição isotópica de 95% (t95%) do carbono-13 do músculo masseter de leitões em ordem decrescente conforme os tratamentos e as curvas isotópicas correspondentes encontram-se na Figura 2. Os leitões que consumiram a dieta contendo 0,1% de nucleotídeos demoraram mais tempo para incorporar o carbono-13 proveniente da dieta, apresentando taxa de turnover mais lenta em relação às demais, pois somente 67% dos átomos de carbono-13 do músculo foram renovados em 49 dias de experimentação, o que resultou nos maiores valores de meia-vida e de 95% de substituição isotópica para esse tecido. Os leitões alimentados com a dieta controle (isenta de nucleotídeos ou glutamato) necessitaram de três horas a menos que os leitões que consumiram a dieta com nucleotídeos para incorporar 50% de átomos de carbono-13 (meia-vida) em seu músculo, apresentando a mesma porcentagem (67%) de troca isotópica para os 49 dias de experimentação que a dieta com nucleotídeos. Por sua vez, os leitões que receberam a dieta contendo 1% de glutamato apresentaram taxas de turnover mais rápidas em relação às dietas com nucleotídeos e a controle, uma vez que a troca dos átomos de carbono-13 no músculo desses animais durante o período experimental foi 5% superior àqueles alimentados com as dietas controle e com nucleotídeos, fornecendo valores de meia-vida e de 95% de substituição isotópica, respectivamente, três dias e de 14 dias mais rápidos que a dieta controle. Os leitões que receberam a dieta contendo a mistura de 0,1% de nucleotídeos e 1% de glutamato durante o mesmo período de experimentação tiveram troca de 73% dos átomos de carbono-13 do tecido muscular, apresentando os menores valores de meia-vida (quatro dias mais rápido que a dieta controle) e de 95% de substituição isotópica (praticamente 19 dias mais rápido do que a dieta controle). O turnover mais rápido verificado na dieta contendo a mistura de 0,1% de nucleotídeos e 1% de glutamato pode ter ocorrido pela ação sinérgica desses aditivos que contribuiu para redução dos valores de meia-vida e de substituição isotópica de 95% dos átomos de carbono-13, pois verificou-se aceleração de 1% da troca isotópica muscular dos leitões que receberam a mistura desses aditivos na dieta (73% dos átomos de carbono-13 trocados em 49 dias de experimento) em relação aos leitões que receberam 1% de glutamato como fonte exclusiva (72% dos átomos de carbono-13 trocados em 49 dias de experimento) e aceleração de 6% em comparação aos leitões que receberam 0,1% de nucleotídeos como fonte exclusiva (67% dos átomos de carbono-13 trocados em 49 dias de experimento). O músculo masseter está envolvido na mastigação e elevação da mandíbula sendo composto em sua maioria por fibras de contração rápida (70% de fibras do tipo II) (Horton et al., 2001) de metabolismo oxidativo-glicolítico (Korfage et al., 2005) que apresentam maior diâmetro do nervo motor, força e velocidade de contração (Pette e Staron, 1990) exigindo dessa forma, grande quantidade de energia para sua contração (Pette e Staron, 1990), proveniente da oxidação das reservas de glutamina presentes no músculo esquelético (Bulus et al., 1989), é possível portanto, que a dieta contendo a mistura de aditivos tenha resultado em menor turnover em razão da melhor utilização desses nutrientes disponíveis na dieta, já que a glutamina é sintetizada a partir do glutamato e fornecedora de esqueletos carbônicos para síntese protéica no músculo (Yoo; Field; McBurney,1997) e os nucleotídeos fornecem a partir de sua oxidação, fosfocreatina (forma que o músculo armazena radicais fosfato) para síntese de novas moléculas de ATP (incorporadas na cabeça da miosina para contração muscular, via repolarização do sarcolema ou bombeamento de cálcio para o retículo sarcoplasmático) (Guimarães-Ferreira, 2014). Amorim et al. (2017), ao estudarem os efeitos da suplementação de glutamina e glutamato no turnover do carbono-13 de músculos (Psoas major e Masseter) de leitões desmamados durante 49 dias de experimentação obteve os seguintes valores de meia-vida do 13C para o músculo masseter: 191,2 dias (dieta controle); 66 dias (dieta com 1% de glutamina); 48 dias (dieta com 1% de glutamato). No presente estudo, o valor de meia-vida (T50%) do 13C do músculo masseter dos leitões que receberam a dieta controle no presente estudo foi mais rápida quase 161 dias em comparação com o valor de meia-vida encontrado por Amorim et al. (2017) para o mesmo tipo de dieta, apresentando ainda T50% do 13C do músculo masseter dos leitões que receberam a dieta contendo 1% de glutamato praticamente 21 dias mais rápida em comparação com a mesma dieta reportada pelos mesmos autores. Em contrapartida, Augusto (2012) verificou valor inferior de meia-vida (12 dias mais rápido) do 13C do músculo reto do abdômen (composto em sua maioria por fibras musculares de contração rápida e metabolismo glicolítico) de leitões aos 21 dias de idade em comparação com o valor de meia-vida obtida no presente estudo para o músculo masseter (mesma composição e metabolismo de fibras musculares) de leitões alimentados com dieta semelhante (basal).Conclusões
A mistura de aditivos (1% glutamato e 0,1% nucleotídeos) acelerou o turnover do carbono-13 no músculo masseter. No entanto, mais pesquisas são necessárias para avaliar a viabilidade econômica da inclusão dos aditivos estudados em dietas comerciais e seu período de oferta mais adequado.Gráficos e Tabelas