
INTERAÇÃO ENTRE pH DA ÁGUA E DENSIDADE DE ESTOCAGEM NOS PARÂMETROS SANGUÍNEOS E METABÓLICOS DE JUVENIS DE TILÁPIA-DO-NILO
2 - União Metropolitana de Educação e Cultura
3 - Universidade Federal da Bahia
4 - Universidade Federal da Bahia
5 - Universidade Federal da Bahia
RESUMO -
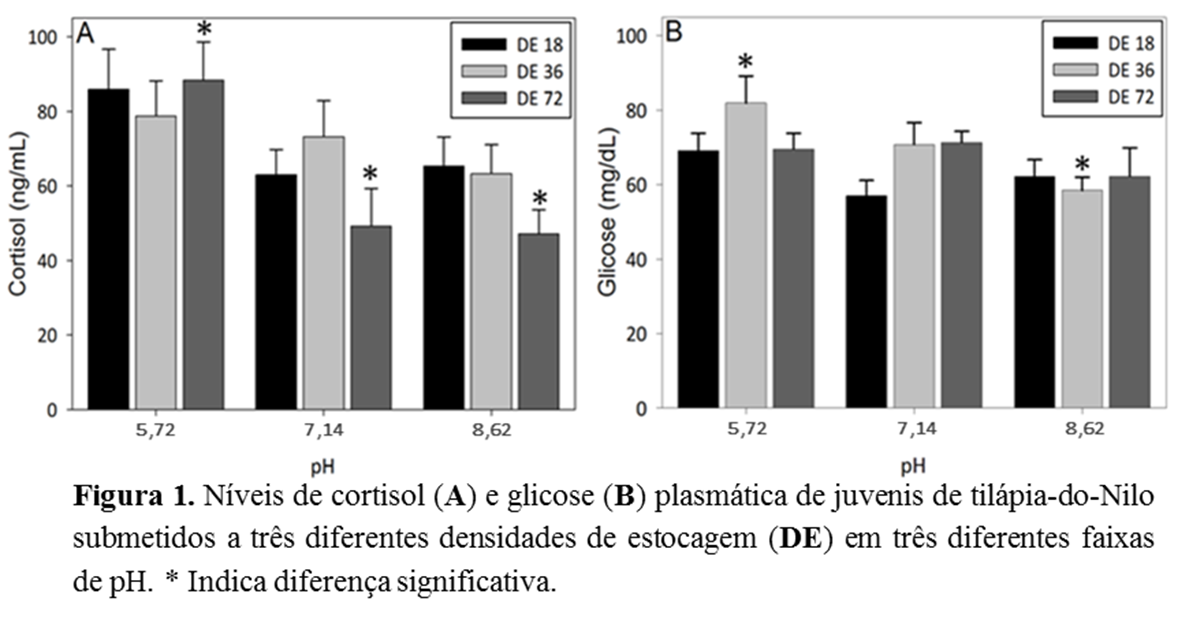
O estudo verificou o efeito da interação entre o pH e a densidade de estocagem (DE) de tilápia-do-Nilo. Foram testadas três DE (18, 36 e 72 peixes em tanques de 200 L) sob três níveis de pH (5,74; 7,14 e; 8,62). Os peixes expostos ao pH ácido e DE 72 apresentaram o maior nível de cortisol em relação aos demais pH na mesma DE (P<0,05). A glicose plasmática foi significativamente maior no pH ácido na DE 36 quando comparado com o pH básico na mesma DE (P<0,05). Em exposição ao pH básico e DE 18, a concentração de HGM foi estatisticamente maior quando comparado com o mesmo pH na DE 36 e pH ácido na mesma DE (P<0,05). O número de leucócitos em pH ácido diminuiu significativamente na DE 72 quando comparado as demais DE (P<0,05). Os heterófilos apresentaram o menor valor no pH neutro e DE 36 em relação ao pH básico na mesma DE (P<0,05). Em conclusão, pH neutro e densidade intermediária reduziram o estresse de tilápias-do-Nilo.
INTERACION BETWEEN pH AND STOCKING DENSITY ON BLOOD AND METABOLIC PARAMETERS OF NILE TILAPIA JUVENILES
ABSTRACT - The study verified the effect of interaction between pH and storage density (SD) in Nile tilapia juveniles. Three SD (18, 36 and 72 fish in 200 L tanks) were tested under three pH levels (5.74, 7.14 and 8.62). Fish exposed to acid pH and DE 72 presented the highest plasma cortisol levels compared to other pH in the same SD (P<0.05). Plasma glucose levels were significantly higher in acidic pH in SD 36 compared to neutral pH in the same SD (P<0.05). On exposure to basic pH and SD 18, the concentration of MGH was statistically higher when compared to the same pH in SD 36 and acid pH in the same SD (P<0.05). The number of leukocytes in acidic pH decreased significantly in SD 72 when compared to other SD (P<0.05). The heterophiles had the lowest value at neutral pH and SD 36 in relation to the basic pH in the same SD (P<0.05). In conclusion, neutral pH and intermediate density reduced the stress of Nile tilapias.Introdução
A necessidade de intensificar os sistemas de criação para atender à demanda de peixes na alimentação humana expõe continuamente os peixes a situações estressantes, como alterações na qualidade de água, manuseio excessivo e adensamentos inadequados (CHAGAS et al., 2009). Tais situações podem comprometer o desenvolvimento, aumentar a susceptibilidade a doenças e reduzir a sobrevivência (BARCELLOS et al., 2011). Dentre os agentes estressantes que podem comprometer a produtividade do setor, atenção deve ser dada ao pH e a densidade de estocagem (DE) uma vez que acarretam distúrbios nas células do sangue e metabólicos.
As análises hematológicas e bioquímicas são de fundamental importância para avaliação do estado fisiológico e o grau de estresse nos peixes (BARCELLOS et al., 2000). Tais resultados têm como finalidade, mitigar os impactos na piscicultura e contribuir com o bem-estar animal e melhorar a produção. O objetivo deste estudo foi verificar se os diferentes níveis de pH e DE alteram os parâmetros sanguíneos e plasmáticos da tilápia-do-Nilo.Revisão Bibliográfica
O pH é um dos parâmetros mais relevantes na produção e varia de acordo com o meio abiótico e biótico. A maioria das espécies de peixes é afetada quando exposta a um pH inferior a 6,0 ou superior a 9,0 (BALDISSEROTTO, 2011). O decréscimo de íons durante a exposição a águas ácidas aumenta distúrbios do hematócrito, hemoglobina e proteínas do plasma e volumes de fluidos que podem matar os peixes por insuficiência circulatória (WOOD, 1989). Grandes quantidades de íons H+ competem com íons Ca++ e Na+, inibindo a captura destes, e afrouxando as junções proteicas da membrana branquial, ocasionado a perda de íons por difusão para o ambiente (BALDISSEROTTO, 2009). Um dos problemas da exposição a águas alcalinas é a inibição da excreção da amônia (NH3), aumentando-a no plasma (CHEZHIAN et al., 2012).
A densidade de estocagem (DE) é outro parâmetro que interfere no crescimento e na sobrevivência dos peixes. Altas DE causam estresse nestes organismos, devido ao aumento da atividade natatória dos peixes, levando a maior demanda catabólica e aumento da área branquial, ocasionando perdas de íons, diminuição do oxigênio dissolvido (ÇAGILTAY et al., 2015). Além disso, aumentam a contaminação da água pelo excesso de excreção nitrogenada. Baixas densidades de estocagem causam o subaproveitamento do espaço e redução da biomassa total. Dessa forma, influenciam o aparecimento de agressões devido à monopolização das zonas, o que desencadeia um crescimento desigual entre os peixes (HASENBEIN et al., 2016).
Repostas ao estresse em peixes estão divididas em três categorias. A resposta primária está ligada ao sistema neuroendócrino que libera as catecolaminas (adrenalina e noradrenalina) na corrente sanguínea (BARCELLOS et al., 2000). Esta liberação ativa a resposta secundária, que correspondem a mudanças fisiológicas e bioquímicas (como glicose e lactato plasmático). As terciárias são relativas ao desempenho, diminuindo o aporte para atividades anabólicas de longo prazo como o crescimento e ganho de peso (BARCELLOS et al., 2000). Durante a resposta terciária, aumenta-se a suscetibilidade a doenças e ocorrem mudanças no comportamento (BARTON et al., 2002).
Materiais e Métodos
Os procedimentos experimentais ocorreram na Universidade Federal da Bahia. Foram utilizados juvenis de tilápia-do-Nilo (n= 1512) com peso médio de 7 g. Os peixes foram acondicionados em caixas de 200 L e submetidos a três diferentes níveis de DE (18, 36 e 72 peixes m³) em três diferentes faixas de pH (5,74; 7,14 e 8,62) perfazendo nove tratamentos em quadruplicata (n= 36 tanques) durante 60 dias. O controle do pH foi mantido com adição de 5 N de NaOH ou H2SO4, diariamente, entre 8:00-17:00 h. A ração tipo pellet (35% PB, 3.600 kcal/kg ED) foi ofertada duas vezes ao dia.
A coleta de sangue foi via punção da veia caudal com o auxílio de seringas heparinizadas. Seis peixes por tanque foram coletados para determinação de cortisol (Kit Vidas® Cortisol S) e glicose plasmática (método enzimático GOD-Trinder, Labtest). Outros quatro peixes foram utilizados para determinação de hematócrito (GOLDENFARB et al., 1971) e leucócitos totais (método colorimétrico). Foi testada a homocedasticidade (teste de Levene) das variâncias. Os dados foram avaliados por análise de variância de duas vias (pH X DE) seguida pelo teste post-hoc de Tukey. Significância foi declara a 5% de probabilidade.
Resultados e Discussão
Os peixes expostos ao pH ácido e DE 72 apresentaram o maior nível de cortisol em relação aos demais pH na mesma DE (P<0,05). A glicose plasmática foi significativamente maior no pH ácido na DE 36 quando comparado com o pH básico na mesma DE (P<0,05) (Figura 1). O aumento de hormônios nos peixes pode ser um indicativo de problemas biológicos, físicos e químicos no cultivo. Sabe-se que a elevação do hormônio corticotrófico é a primeira resposta dos animais ao estresse (BARTON & IWAMA, 1991). Isto indica, neste estudo, que os peixes expostos ao pH ácido em altas DE sofreram mais estresse. Este hormônio tem função catabólica, uma vez que eleva os níveis de glicose plasmática pela glicogenólise (VINODHINI & NARAYANAN, 2009), para reagir ao potencial estressor. Entretanto, os níveis de glicose foram significativamente elevados no pH ácido apenas na DE 36. A glicose é a principal fonte de energia em condições adversas e um bom indicador de transtornos fisiológicos (BRANDÃO et al., 2004).
Em exposição ao pH básico e DE 18, a concentração de HGM foi estatisticamente maior quando comparado com o mesmo pH na DE 36 e pH ácido na mesma DE (P<0,05) (Tabela 1). A hemoglobina é responsável pelo transporte de oxigênio no sangue (SRIVASTAVA & SAHAI 1987); baixa DE em combinação com o pH alto, podem ter exigido uma maior carga de transporte de oxigênio. Devido ao estresse das agressões promovidas pela monopolização das zonas (HASENBEIN et al., 2016), e potencializadas pela exposição ao pH básico. Acarretando assim, uma maior atividade natatória, consequentemente maior demanda por O2. O número de leucócitos em pH ácido diminuiu significativamente na DE 72 quando comparado às demais (P<0,05). Os heterófilos apresentaram o menor valor no pH neutro e DE 36 em relação ao pH básico na mesma DE (P<0,05) (Tabela 2). O estresse crônico implica na supressão das repostas imunes; portanto, nestas condições, os peixes estão mais propensos a uma infecção (TORT, 2011).Conclusões
Em conclusão, pH neutro e densidade intermediária reduziram o estresse de tilápia-do-Nilo. Adicionalmente, peixes expostos ao pH 5,74 foram mais impactados com o estresse, uma vez que obteviram maiores alterações nos parâmetros sanguíneos e metabólicos.Gráficos e Tabelas

Referências
BALDISSEROTTO, B. Water pH and hardness affect growth of freshwater teleosts. Brazilian Journal of Animal Science, 40:138-144, 2011.
BALDISSEROTTO, Bernardo. Fisiologia de peixes aplicada à piscicultura 2 edição. Santa Maria, SC, Brazil: UFSM, 2009.
BARCELLOS, L.J.G. SOUZA, S.M.G. WOEHL, V.M.. Estresse em peixes: Fisiologia da Resposta ao Estresse, Causas e Consequências (Revisão). Bol Inst Pesca. 26 (1): 99-111, 2000.
BARCELLOS, L.J.G., VOLPATO, G.L., BARRETO, R.E., COLDEBELLA, I., FERREIRA, D. Chemical communication of handling in fish. Physiol. Behav. 103, 372–375, 2011.
BARTON BA, IWAMA GK. Physiological changes in fish from stress in aquaculture with emphasis on the response and effects of corticosteroids. Annu Rev Fish Dis 1:3–26, 1991.
BARTON, B.A.; MORGAN, J.D.; VIJAYAN, M.M. Physiological and condition-related indicators of environmental stress in fish. In: Adams (ed.). Biological indicator of aquatic ecosystem stress, Bestherda, Maryland, American Fisheries Society, p.289-320, 2002.
BRANDÃO, F.R., GOMES, L.C., CHAGAS, E.C., DE ARAÚJO, L.D. Densidade de estocagem de juvenis de tambaqui durante a recria em tanques-rede. Pesq. Agrop. Brasileira 39, 357–362, 2004.
ÇAGILTAY, F., ERKAN, N., ULUSOY, Ş., SELCUK, A., ÖZDEN, Ö. Effects of stock density on texture-colour quality and chemical composition of rainbow trout (Oncorhynchus mykiss). Iranian Journal of Fisheries Sciences,14(3), 687-698, 2015.
CHAGAS, E.C.; PILARSKI, F.; SAKABE, R.; MASSAGO, H.; FABREGAT, T.E.H.P. Suplementos na dieta para manutenção da saúde de peixes. In: TAVARES-DIAS, M. (Ed.). Manejo e sanidade de peixes em cultivo. Embrapa, p.132-225, 2009.
CHEZHIAN, A.; SENTHAMILSELVAN, D.; KABILAN, N. Histological changes induced by ammonia and ph on the gills of fresh water fish Cyprinus carpio var. communis (Linnaeus). Asian J. Anim. Vet. Adv, v. 7, p. 588-596, 2012.
GOLDENFARB, P.B. et al. Reproducibility in the hematology laboratory: the microhematocrit determination. American Journal of Clinical Pathology, v. 56, n. 1, p. 35-39, 1971.
HASENBEIN, M., FANGUE, N. A., GEIST, J. P., KOMOROSKE, L. M., CONNON, R. E. Physiological stress biomarkers reveal stocking density effects in late larval Delta Smelt (Hypomesus transpacificus). Aquaculture, 450, 108-115, 2016.
SRIVASTAVA AK, SAHAI I. Effects of loading density on carbohydrate metabolism and hematology in the Indian freshwater catfish, (Heteropneustes fossilis). Aquaculture 66:275–286, 1987.
TORT, L. Stress and immune modulation in fish. Dev. Comp. Immunol. 35, 1366–1375, 2011.
VINODHINI R, NARAYANAN M. The Impact of toxic heavy metals on the hematological parameters in common Carp (Cyprinus carpio L.). Iran J Environ Health Sci Eng 6:23–28, 2009.
WOOD, C. M. The physiological problems of fish in acid waters. Acid toxicity and aquatic animals, 125-152, 1989.


