TOLERÂNCIA DE ISOLADOS DE RIZÓBIOS NATIVOS DE JUREMA PRETA (Mimosa tenuiflora (Wild) Poiret) AO ESTRESSE SALINO
2 - Universidade Federal da Paraíba, Areia – PB, Brasil
3 - Universidade Federal da Paraíba, Areia – PB, Brasil
4 - Universidade Federal da Paraíba, Areia – PB, Brasil
5 - Universidade Federal da Paraíba, Areia – PB, Brasil
6 - Universidade Federal da Paraíba, Areia – PB, Brasil
7 - Universidade Federal da Paraíba, Areia – PB, Brasil
8 - Universidade Federal da Paraíba, Areia – PB, Brasil
RESUMO -
A adaptação de bactérias diazotróficas simbióticas a ambientes desfavoráveis tem chamado a atenção de muitos pesquisadores, por isso, o objetivo deste trabalho foi avaliar o crescimento de rizóbios nativos do município de Sertânia- PE, associados à espécie Mimosa tenuiflora em diferentes concentrações salinas. A habilidade de crescer em diferentes concentrações de sal foi determinada pela incubação dos rizóbios em tubos de ensaio contendo 5 mL de meio de cultura extrato de levedura e manitol (LM), acrescidos de 0,1; 0,5; 1; 5 e 10 % correspondente à 0,27; 1,35; 2,70; 13,5; 27 gL-1 de NaCl solúvel. Os tubos com turbidez na amostra foram considerados com crescimento positivo e, não turvos como negativos. Os rizóbios nativos de Mimosa tenuiflora apresentam tolerância a salinidade de até 103,8 dS m-1.
TOLERANCE OF ISOLATES OF NATIVE RIZÓBIOS OF JUREMA PRETA (Mimosa tenuiflora (Wild) Poiret) TO THE STRESS SALINE
ABSTRACT - The adaptation of symbiotic diazotrophic bacteria to unfavorable environments has attracted the attention of many researchers. Therefore, the objective of this work was to evaluate the growth of native rhizobia in the municipality of Sertânia-PE, associated to Mimosa tenuiflora species in different saline concentrations. The ability to grow at different salt concentrations was determined by incubating the rhizobia in test tubes containing 5 mL yeast extract and mannitol (LM) plus 0.1; 0.5; 1; 5 and 10% corresponding to 0.27; 1.35; 2.70; 13.5; 27 gL-1 of soluble NaCl. The tubes with turbidity in the sample were considered positive growth and not turbid as negative. The native rhizobia of Mimosa tenuiflora show salinity tolerance up to 103.8 dS m-1.Introdução
O cultivo de fabáceas com alto nível proteico e potencial forrageiro é tido como alternativa viável para a maximização da produção animal, além de contribuir para o aumento do aporte de matéria orgânica do solo. No entanto, algumas características do solo como acidez e salinidade afetam fortemente a produtividade das fabáceas, pois, interferem diretamente na fixação do nitrogênio pelos rizóbios em simbiose. A salinidade do solo, que atinge quase 40% da superfície terrestre do mundo é um dos fatores abióticos que deve ser levado em consideração por prejudicar a agricultura, principalmente em zonas áridas e semiáridas (Lebrazi; Benbrahim, 2014). No entanto, a adaptação de bactérias diazotróficas simbióticas a ambientes desfavoráveis tem chamado a atenção de muitos pesquisadores como Faghire et al. (2012), que ao identificarem cepas de bactérias simbióticas sob condições de solos salinos, observaram que a osmolaridade das bactérias foi variável, contudo, todas as estirpes foram capazes de crescer na presença de concentrações de NaCl variando de 1,5% a 3%. Partindo desse princípio, objetivou-se avaliar crescimento de rizóbios nativos do município de Sertânia-PE, associados à espécie Mimosa tenuiflora em diferentes concentrações salinas.Revisão Bibliográfica
A Fixação Biológica de Nitrogênio (FBN) é o processo pelo qual alguns microrganismos de vida livre, associativos ou simbióticos fixam o nitrogênio atmosférico. A partir do momento em que esses microrganismos interagem simbioticamente com hospedeiros específicos, formando estruturas especializadas para fixar o nitrogênio, recebem o nome de microrganismos diazotróficos simbióticos, esses por sua vez, são agrupados em dois grupos principais de bactérias que não são relacionados filogeneticamente: Os rizóbios Alfa-proteobactérias, que se associam essencialmente com fabáceas pertencentes a uma superfamília de angiospermas, e Frankia Actinobactérias, que se associam a uma gama mais ampla de plantas (FRANCHE et al., 2009). A salinidade contribui negativamente para a FBN. Todavia, os rizóbios podem usar mecanismos distintos na adaptação osmótica. Quando exposto ao estresse salino as bactérias fazem alterações na morfologia celular e modificações no padrão de polissacarídeos extracelulares, expulsão de prótons H + do interior celular, aumento dos teores de potássio e concentração de glutamato no citoplasma das células microbianas (VENTORINO et al., 2012; CAO et al., 2014; LEBRAZI & BENBRAHIM, 2014).
Materiais e Métodos
Em estudos prévios foram obtidos 54 isolados de rizóbios nativos de Mimosa tenuiflora cultivada em solo proveniente de uma área de Caatinga do município de Sertânia, Pernambuco – Brasil. Os testes de crescimento (Vincent, 1970). foram realizados no Laboratório de Bitecnologia do Solo da Universidade Federal da Paraíba, Centro de Ciências Agrárias, Areia – Paraíba. A habilidade de crescer em diferentes concentrações de sal foi determinada pela incubação dos rizóbios em tubos de ensaio contendo 5 mL de meio de cultura Extrato de levedura e manitol (LM), acrescidos de 0,1; 0,5; 1; 5 e 10 % correspondente à 0,27; 1,35; 2,70; 13,5; 27 gL-1 de NaCl solúvel. Os tubos foram incubados a uma temperatura ambiente sob agitação de 120 rpm durante três dias. Como a salinidade do solo é expressa em Condutividade Elétrica do extrato de saturação – (CEes), foi determinada a CEes em dS m-1 de cada concentração de NaCl em meio LM líquido, correspondendo a 2,77; 8,32; 16,76; 64,70; 103,8 dS m-1 respectivamente. Os tubos com turbidez na amostra foram considerados com crescimento positivo e não turvos como negativos. Duas testemunhas sem inoculação submetidas às mesmas condições de crescimento foram utilizadas na comparação das amostras.Resultados e Discussão
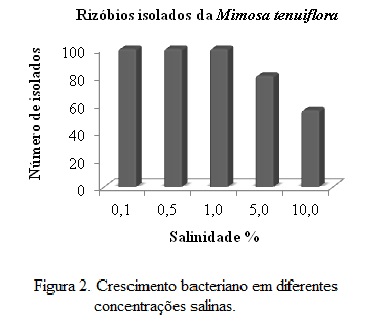
Os isolados de rizóbios nativos, obtidos no munícipio de Sertânia em simbiose com a fabácea Mimosa tenuiflora, que apresentaram turbidez no caldo foram considedas com crescimento positivo (Figura 1), apresentando crescimento em meio salino. Houve crescimento em 100% dos isolados submetidos aos níveis 0,1; 0,5 e 1% de salinidade (Figura 2). Houve decrécimo no crescimento bacteriano a medida que a concentração de sal no meio de cultura aumentou para 5 e 10%, crescendo apenas um total de 80,5 e 55,5% de isolados de rizóbios, respectivamente. De acordo com Laranjo e Oliveira (2011), o acúmulo de solutos intracelulares compatíveis e enrijecimento da parede celular é um dos mecanismos de resposta a salinidade causado por NaCl. Segundo Vriezen et al. (2007), os osmoprotetores e solutos compatíveis como hidratos de carbono e dissacarídeos também podem aumentar a sobrevivência durante a dessecação causada por ambientes salinos. Os rizóbios resistentes a estresses ambientais encontrados no Nordeste do Brasil podem ajudar na seleção de estirpes adaptadas, sendo competitivas e aptas a proporcionar a fixação biológica de nitrogênio, tendo em vista a obtenção de inoculantes para outras culturas.Conclusões
Os rizóbios nativos do município de Sertânia-PE, isolados da espécie Mimosa tenuiflora apresentam tolerância a salinidade de até 103,8 dS m-1.Gráficos e Tabelas