Inclusão de leveduras vivas e mananoligossacarídeos em dietas à base de grãos para bovinos: resposta inflamatória
2 - Universidade Estadual de Maringá
3 - Universidade Estadual de Maringá
4 - Universidade Estadual de Maringá
5 - Universidade Estadual de Maringá
6 - Universidade Estadual de Maringá
7 - Universidade Estadual de Maringá
RESUMO -
Objetivou-se estudar os efeitos da suplementação com leveduras vivas e mananoligossacarídeos (MOS) sobre a resposta inflamatória de bovinos alimentados com dietas à base de grãos. Foram utilizados três bovinos machos, da raça Holandesa, com peso corporal médio de 497+3kg, providos de cânula ruminal e duodenal, em um delineamento experimental Quadrado Latino 3×3. Os animais foram mantidos em confinamento, recebendo dieta com 95% de concentrado e os tratamentos estudados foram: controle (sem aditivo); 1,5 g/ kg MS de leveduras vivas (Saccharomyces cerevisiae-NCYC 996-1010 UFC/g) e 1,5 g/kg MS de MOS. Não houve efeito dos aditivos (P>0,05) sobre as concentrações de lipopolissacarídeos (LPS) no rúmen e no fluido duodenal. O uso dos aditivos reduziu (P≤0,05) as concentrações plasmáticas de LPS e soro amiloide A. A suplementação com leveduras vivas e com MOS reduziu a intensidade do processo inflamatório em bovinos recebendo dietas à base de grãos.
Inclusion of live yeasts and mannanoligosaccharides in grain-based diets for cattle: inflammatory response
ABSTRACT - The objective of this experiment was to study the effects of live yeasts and mannanoligosaccharides (MOS) supplementation on the inflammatory response of cattle fed grain-based diets. Three Holstein steers with mean body weight of 497+3 kg and ruminal and duodenal cannulas were used, in a 3 x 3 Latin Square experimental design. The animals were kept in confinement, receiving a diet with 95% concentrate and treatments studied were: control (without additive); 1.5 g of live yeasts/kg DM (Saccharomyces cerevisiae-NCYC 996-1010 CFU/g) and 1.5 g of MOS/kg DM. There was no additives effect (P>0.05) on lipopolysaccharide (LPS) concentrations in rumen and duodenal fluid. Plasma concentrations of LPS and amyloid A serum were reduced (P<0.05) by addition of the additives. The supplementation with live yeasts and MOS reduced the intensity of the inflammatory process in cattle receiving grain-based diets.Introdução
A utilização de dietas ricas em concentrado, principalmente grãos, é uma prática cada vez mais comum na alimentação de ruminantes visando aumentar a produtividade. No entanto, essas dietas ricas em carboidratos rapidamente fermentáveis no rúmen estão relacionadas com alterações metabólicas como a acidose ruminal subaguda (Gómez et al., 2014). Esse distúrbio se desenvolve, principalmente, pela acumulação excessiva de ácidos orgânicos no rúmen, os quais causam a queda do pH ruminal (<5,8). A acidose ruminal causa a morte de bactérias Gram-negativas no rúmen, com a consequente liberação de lipopolissacarídeos (endotoxinas) ativando uma cascata de mediadores inflamatórios, que afetam o desempenho produtivo do animal e acarretam importantes perdas econômicas (Khafipour et al., 2009; Dong et al., 2011).
Nesse contexto, a mistura uniforme da ração, o manejo de cocho, a formulação adequada da ração e a inclusão de aditivos, tornam-se um ponto chave para minimizar ou eliminar os efeitos negativos da acidose (Lei et al., 2013).
O presente estudo foi realizado para avaliar os efeitos da suplementação dietética com leveduras vivas (Saccharomyces cerevisiae), a parede celular de leveduras (mananoligossacarídeos), sobre a resposta inflamatória de bovinos alimentados com dietas à base de grãos.
Revisão Bibliográfica
Com os avanços tecnológicos observados na pecuária e, sua implementação em muitas das propriedades brasileiras, a nutrição de ruminantes tem se tornado fundamental melhorar o desempenho e a produtividade dos animais. Desta forma, a utilização de dietas ricas em concentrados, com maior aporte de energia para o animal, constituem uma estratégia para aumentar o ganho de peso e reduzir os dias de confinamento, tornando a atividade produtiva mais rentável. Entretanto, a ingestão de dietas ricas em concentrado, aumentam o risco de distúrbios digestivos como a acidose ruminal subaguda (Gómez et al., 2014).
Este distúrbio se desenvolve, principalmente, pela acumulação excessiva de ácidos orgânicos (ácidos graxos de cadeia curta e lactato), causando uma queda acentuada do pH ruminal (>5,8), diminuindo, simultaneamente, a capacidade de tamponamento do rúmen, reduzindo a eficiência da flora microbiana (Khafipour et al., 2009).
A excessiva queda do pH ruminal pode causar a morte de bactérias sensíveis ao meio ácido, liberando componentes da parede celular presente nas bactérias Gram-negativas, como os lipopolissacarídeos (LPS), compostos tóxicos para o hospedeiro (Chang et al., 2015). A translocação dos LPS para a corrente sanguínea provoca uma resposta inflamatória, desencadeando a produção de proteínas de fase aguda, como a haptoglobina e o soro amilóide A (Gómez et al., 2014).
Os problemas causados pela acidose ruminal subaguda, são de difícil tratamento, tornando-se necessário estabelecer estratégias nutricionais que permitam prevenir esse distúrbio digestivo. Nesse contexto, a inclusão de aditivos, tornam-se um ponto chave para minimizar ou eliminar os efeitos negativos da acidose.
Aditivos como os probióticos (leveduras vivas como a Saccharomyces cerevisiae) e prebióticos (mananoligossacarídeos), são utilizados na nutrição de ruminantes visando melhorar a digestão dos nutrientes, o desempenho do animal e reduzir o risco de acidose ruminal (González et al., 2012). Entre os principais benefícios mencionados na literatura em relação aos probióticos e os prebióticos, destacam-se a inibição de bactérias produtoras de lactato, melhorar a estabilidade do pH ruminal e ativar o sistema imunológico dos animais (Lei et al., 2013), além de promover a remoção de moléculas tóxicas, evitando lesões da mucosa gastrointestinal. Assim, estes aditivos podem contribuir a melhorar o desempenho e a saúde do animal (Uyeno et al., 2015).
Materiais e Métodos
Foram utilizados três bovinos machos castrados, da raça Holandesa, com peso corporal médio de 497+3 kg, providos de cânula ruminal e duodenal, distribuídos em delineamento experimental Quadrado latino 3x3, com duração de 21 dias cada período. Os animais permaneceram em baias com 8,75m2, dotadas de comedouro de polietileno individual e bebedouro automático.
As dietas foram constituídas por 5% de bagaço de cana e 95% de ração concentrada, elaborada com grão de milho moído, ureia e mistura mineral. Os tratamentos estudados foram: Controle (sem aditivo); 1,5 g/kg MS leveduras vivas (Saccharomyces cerevisiae– NCYC 996–1010 UFC/g) e 1,5 g/kg MS de mananoligossacarídeos (MOS: 22% de mananos e 24% de β-glucanos). Antes do início do experimento, foi realizado protocolo de adaptação em escada (Step up) durante 15 dias.
Nos 18º e 20º dia de cada período experimental foram realizadas coletas de sangue, em tubos vacutainer com heparina, por meio de punção da veia jugular 15 min antes da alimentação matinal (07:45h) e, posteriormente, às 6 e 12 h após a primeira alimentação. O sangue foi centrifugado a 3000 x g 10 min para a obtenção do plasma, armazenado em tubos eppendorf a -20ºC para posteriores análises de lipopolissacarídeos, utilizando-se o kit comercial para determinação de endotoxinas (GenScript) e análises de haptoglobinas e soro amilóide A realizadas com kits comerciais Tridelta Multispecies Assay. Nos mesmos dias e horários, foi realizada uma coleta de líquido ruminal e digesta duodenal para determinação de LPS, assim como descrito por Khafipour et al. (2009).
A análise estatística dos dados foi realizada utilizando-se o procedimento GLM do pacote estatístico SAS. O modelo matemático utilizado para a análise foi: Yijk = µ+ Ai + Pj + Tk + eijk, onde, Yijk= variável dependente; µ = média geral; Ai = efeito de animal; Pj= efeito de período; Tk= efeito de tratamento; eijk= erro. As médias entre os tratamentos foram comparadas pelo teste Tukey a α=0,05 de probabilidade.
Resultados e Discussão
Os aditivos estudados não influenciaram (P>0,05) as concentrações de LPS livres no rúmen e na digesta duodenal. No entanto, reduziram drasticamente (P<0,05) as concentrações de LPS no plasma quando comparados com os animais alimentados com a dieta controle (Tabela 1).
Este efeito pode estar relacionado com a habilidade das leveduras vivas e dos MOS em “ligar” toxinas, permitindo que essas substâncias tóxicas passem pelo trato digestório sem serem absorvidas. Essa habilidade deve-se à presença de β-D-glucanas na parede celular da levedura, que além de reconhecer e ligar toxinas bacterianas, são responsáveis por dar estrutura à levedura (Lei et al., 2013). A ligação MOS-LPS dá-se pela carga positiva da parede celular das leveduras, que absorve os ligantes negativos presentes nas endotoxinas, visto que os mesmos são atraídos por forças eletrostáticas (Lei et al., 2013).
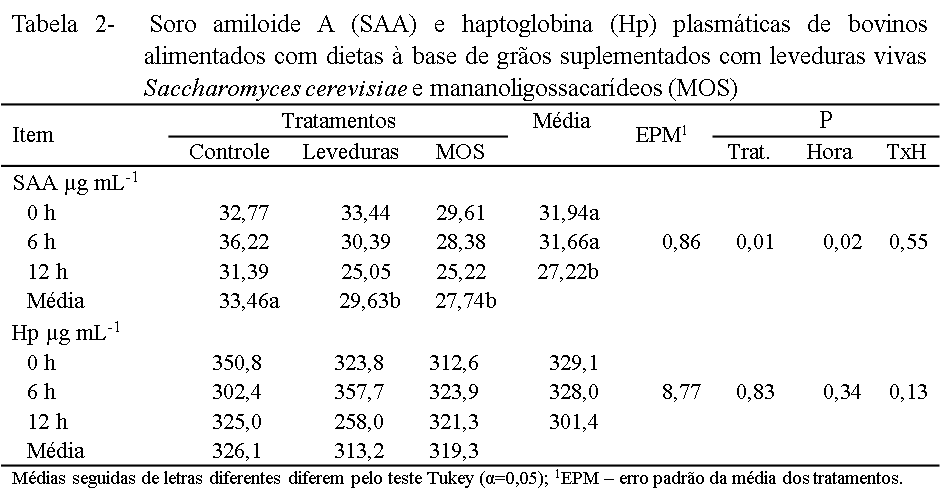
Os níveis sanguíneos das proteínas de fase aguda (PFA), soro amiloide A (SAA) e haptoglobinas (Hp) encontravam-se acima dos valores basais (<25 e <50 µg mL-1, respectivamente; Tabela 2), indicando que os animais desenvolveram uma resposta inflamatória aguda, devido ao alto consumo de concentrado (95% de concentrado).
O aumento das PFA está relacionado com a presença de LPS na circulação sistêmica, os quais estimulam a liberação de citocinas pró-inflamatórias, tais como o fator de necrose tumoral (α-TNF), interleucinas 1 e 6 (IL-1 e IL-6) pelos macrófagos do fígado. Por sua vez, estes macrófagos ativam receptores hepáticos e iniciam a síntese de proteínas de fase aguda como, SAA e Hp, utilizadas como marcadores de resposta inflamatória do tipo agudo (Dong et al., 2011).
As concentrações plasmáticas de SAA foram menores nos animais (P<0,05) que receberam adição de leveduras vivas e MOS, quando comparados aos animas que receberam a dieta controle. Na dieta controle, foi observado um aumento (P<0,05) das concentrações de SAA, seis horas após a primeira alimentação, mas nos tratamentos que continham leveduras vivas e MOS, as concentrações dessas proteínas foram reduzidas (P<0,05) conforme avançaram os horários de coleta (P<0,05; Tabela 2).
Este resultado possivelmente ocorreu como consequência da presença de β-glucanas e mananas na parede celular das leveduras (MOS), as quais podem deprimir a resposta imunológica pró-inflamatória, através da produção de citocinas anti-inflamatórias, e à diminuição transitória na expressão do receptor Toll–receptor tipo 4 (TLR-4), envolvidos na produção de citoquinas pró-inflamatórias e as proteínas de fase aguda (Luhm et al., 2006).
Do mesmo modo, a redução das concentrações de SAA pela suplementação com leveduras vivas Saccharomyces cerevisiae pode ser devida ao seu efeito estabilizador do pH ruminal, pois esse parâmetro tem uma relação direta com a liberação de LPS e o processo inflamatório. Por outro lado, não foi observado efeito (P>0,05) nas concentrações de Hp no sangue dos tratamentos, horários de coleta, nem a interação entre estes fatores.
Conclusões
A suplementação de leveduras vivas Saccharomyces cerevisiae (1,5 g/kg MS; 1010 UFC/g) e de mananoligossacarídeos (1,5 g/kg MS) reduziu a intensidade do processo inflamatório em bovinos recebendo dietas à base de grãos.
Gráficos e Tabelas