Uso da Quercetina Como Antioxidante na Maturação In Vitro de Oócitos Caprinos
2 - Universidade Federal do Vale do São Francisco
3 - Universidade Federal do Vale do São Francisco
4 - Universidade Federal do Vale do São Francisco
5 - Universidade Federal do Vale do São Francisco
6 - Universidade Federal do Vale do São Francisco
7 - Universidade Federal do Vale do São Francisco
8 - Universidade Federal do Vale do São Francisco
RESUMO -
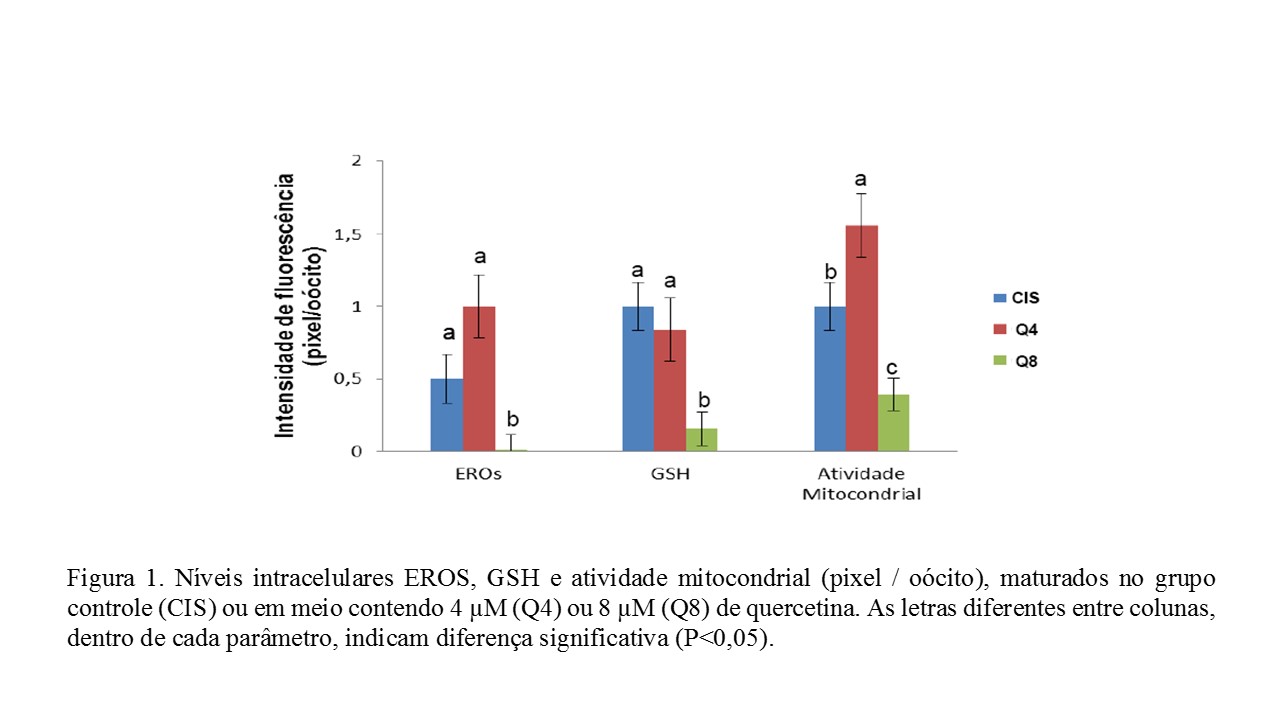
O objetivo deste projeto foi avaliar a substituição de cisteamina por quercetina na maturação in vitro de oócitos caprinos, especialmente na atividade mitocondrial. Os complexos cumulus oócitos (CCOs) de melhor qualidade foram divididos em 3 grupos: CIS (controle), CCOs imersos em meio de TCM-199, com suplementos incluindo cisteamina; já nos Q4 e Q8, CCOs foram imersos no meio controle, mas sem cisteamina e com 4 μM ou 8 μM de quercetina, respectivamente. Após a MIV, 10 oócitos maduros de cada grupo foram desnudos, sendo os níveis de GSH, EROS e a atividade mitocondrial mensurados. Os oócitos tratados com 8 µM de quercetina apresentaram menores níveis de EROS e GSH que aqueles maturados nos grupos CIS e Q4. Em relação à atividade mitocondrial, os oócitos maturados do grupo Q4 foram superiores aos tratados nos grupos CIS e Q8. Concluiu-se que 4 µM de quercetina pode ser utilizado em substituição à cisteamina, porém 8 µM de quercetina é prejudicial ao oócito caprino maturado in vitro.
Use of Quercetin as Antioxidant on In Vitro Maturation of Goat Oocytes
ABSTRACT - Cysteamine is used at IVM of goat oocytes, but cysteamine is 3.6 times more expensive than flavonoid quercetin. To evaluate the replacement of cysteamine by quercetin at IVM of goat oocytes, especially in mitochondrial activity, COCs were divided into 3 groups: CIS = COCs + TCM-199 + suplements + cysteamine; Q4 = CIS – cysteamine + 4 μM of quercetin; e Q8 = CIS – cysteamine + 8 μM of quercetin. After IVM, 10 COCs from each group were used to measure GSH and ROS levels and mitochondrial activity. Data expressed as percentage were compared with Chi-Square test. Means were compared using Student Newman Keuls test (P < 0.05). ROS (0.0 pixel) e GSH (0.2 pixels) in Q8 group < CIS (0.5 e 1.0 pixel) e Q4 (1.0 e 0.8 pixels) groups. mitochondrial activity in Q4 (1.7 pixel) > CIS (1.0 pixel) and Q8 (0.4 pixels) groups. In conclusion, quercetin can be used instead of cysteamine on in vitro maturation of goat oocytes.Introdução
A produção in vitro de embriões (PIV) caprinos tem enfrentado uma série de entraves: baixas taxas de recuperação oocitária na colheita de oócitos, baixa competência de desenvolvimento oocitário na maturação in vitro (MIV), problemas de capacitação espermática na fecundação in vitro (FIV) e bloqueio do desenvolvimento embrionário no cultivo in vitro de embriões (SOUZA-FABJAN et al., 2016). Nesse contexto, a MIV tem papel fundamental, pois bons resultados na maturação oocitária incrementam os índices de produção embrionária. Diversos meios de maturação oocitária têm sido testados, na tentativa de obter os resultados esperados, mas processos oxidativos inerentes ao processo de MIV têm impedido as altas taxas de produção embrionária (SOUZA-FABJAN et al., 2016). Suplementar os meios de maturação oocitária com substâncias antioxidantes parece ser o caminho para aperfeiçoar a MIV de oócitos caprinos. Entretanto, na literatura, não há relatos sobre o efeito da inclusão de quercetina como antioxidante na MIV de oócitos caprinos, principalmente na atividade mitocondrial de oócitos maturados. O objetivo do trabalho foi avaliar o efeito de duas concentrações (4 µM e 8 µM) de quercetina como antioxidante alternativo à cisteamina na maturação in vitro de oócitos caprinos, especificamente com relação à produção de EROS, de glutationa reduzida intracelular (GSH) e à atividade mitocondrial oocitária.Revisão Bibliográfica
A produção exacerbada de espécies reativas de oxigênio (EROs) na maturação in vitro (MIV) de oócitos pode culminar com o bloqueio ou retardo do desenvolvimento oocitário, afetando, negativamente, a viabilidade destas células (KANG et al., 2013). Nesse sentido, algumas substâncias inibidoras de EROS, ou seja, os antioxidantes têm sido considerados importantes componentes para complementar os meios de MIV, como, por exemplo, a cisteamina (MUDO et al., 2015) e a vitamina E (SILVA, 2015), dentre outras. No entanto, apesar de apresentarem resultados satisfatórios, estas substâncias têm elevado o custo da composição dos meios. A quercetina (3, 5, 7, 3’-4’-pentahidroxiflavona) é um flavonoide natural, largamente encontrado em vegetais, grãos, frutas, flores, chás, possuindo propriedades terapêuticas e potencial antioxidante biológico (BEHLING et al., 2004). A presença de quercetina resultou em excelentes taxas de maturação de oócitos suínos e posterior desenvolvimento até o estádio de blastocisto, através da redução dos níveis de EROS intracelulares (ORLOVSCHI; MICLEA; ZAHAN, 2014). Somado a isso, seu custo de aquisição é 3,6 vezes mais baixo, quando comparado ao antioxidante convencional cisteamina, o que favorece a redução de custos na MIV. No tocante aos antioxidantes endógenos ou enzimáticos, as substâncias mais conhecidas são a superóxido dismutase (SOD), catalase e glutationa (GSH). De modo especial, a GSH está em maior concentração no oócito quando comparada as outras enzimas supracitadas. Sua síntese é regulada por gonadotrofinas e sua concentração tende a aumentar no decorrer do processo de maturação, principalmente em oócitos no estádio de metáfase II. Essa enzima pode ser considerada um importante marcador bioquímico a fim de estimar a viabilidade e maturação oocitária (ZUELKE et al., 2003). A atividade mitocondrial em oócitos é considerada um excelente marcador de qualidade e viabilidade celular. Uma vez ativas, as mitocôndrias asseguram competência funcional dos oócitos, principalmente, durante a maturação nuclear e/ou citoplasmática (MOUSSA et al., 2015). Somado a isso, as mitocôndrias desempenham um importante papel na morte celular programada.Materiais e Métodos
Ovários caprinos (n = 88) foram obtidos em abatedouro e transportados até o laboratório (SOUZA-FABJAN et al., 2016). Os ovários foram lavados, três vezes, em solução salina aquecida e, posteriormente, acondicionados em banho-maria, a 30ºC. Para a colheita dos oócitos, foi utilizada uma bomba de vácuo, a uma pressão de 6 a 8 mL/min e agulha 18G. Logo após a colheita, os complexos cumulus oócitos (CCOs) foram homogeneamente divididos em três grupos de maturação: no Grupo CIS (controle), os CCOs foram imersos em TCM-199, suplementado com EGF (10 µL/mL), FSH/LH (10 µL/mL), soro de ovelha em estro (100 µL/mL) e cisteamina (10 µL/mL); já nos Grupos Q4 e Q8, os CCOs foram imersos no meio controle, porém sem cisteamina e com 4 μM ou 8 μM de quercetina, respectivamente. Os CCOs (n = 50) foram dispostos em placas de cinco poços de 500 µL de meio MIV, sob óleo mineral, durante 24 horas, em estufa de cultivo, a 38,5ºC, em uma atmosfera umidificada com 5% de CO2. Após a MIV, 10 oócitos maduros de cada grupo foram desnudos, sendo os níveis de GSH, EROS e a atividade mitocondrial mensurados (LINS et al., 2016). Para tanto, os oócitos foram desnudos e incubados (na ausência de luz) durante 30 minutos em PBS, suplementado com 10 mM de 2’,7’-diacetato de diclorodihidrofluoresceína e 10 mM de CellTracker® e 100 mM de MitoTracker Red, a 37°C. Após coloração, os oócitos foram lavados com PBS e a fluorescência foi observada em microscópio de epifluorescência com filtros de UV de 370 nm, 460 nm e 579-599 mM para GSH, EROS e atividade mitocondrial, respectivamente. As intensidades de fluorescência dos oócitos foram analisadas utilizando o software Image J. Os dados percentuais foram comparados, utilizando o teste do Qui-quadrado, por meio do software estatístico Epi Info (Epi Info 7.1.5.0, Atlanta, GA, EUA, 2015). As médias foram comparadas pelo teste de Student Newman Keuls. As diferenças foram consideradas significativas quando P<0,05.Resultados e Discussão
No tocante à emissão de fluorescência quantificada através do número de pixels, os níveis intracelulares oocitários de ERO, GSH e de atividade mitocondrial estão demonstrados na Figura 1. Os oócitos tratados com 8 µM de quercetina apresentaram menores níveis de ERO e GSH que aqueles maturados nos grupos CIS e Q4, entre os quais não houve diferença significativa. Já com relação à atividade mitocondrial, os oócitos maturados na presença de 4 µM de quercetina (Q4) foram significativamente superiores que aqueles tratados nos grupos CIS e Q8. Ainda com relação à atividade mitocondrial, é importante destacar que os oócitos maturados no grupo Q8 foram significativamente inferiores que aqueles maturados nos grupos CIS e Q4. Os efeitos positivos da quercetina e da cisteamina durante a maturação ou cultivo in vitro de oócitos são atribuídos ao seu potencial antioxidante, que, em concentrações adequadas, são capazes de mediar o equilíbrio da produção de EROS, resultando, por sua vez, em células com melhor qualidade e viabilidade (ORLOVSCHI; MICLEA; ZAHAN, 2014). Entretanto, não observamos diferenças significativas nos níveis de EROS e GSH intracelulares entre os grupos CIS e Q4. Nossos dados diferem dos achados em bovinos (GUEMRA et al., 2013), que encontraram menores níveis de GSH em oócitos maturados na presença de quercetina (2 e 10 µM). A quercetina equilibra a produção de EROS, por interagir com íons superóxido, quelar íons ferro e por reduzir a peroxidação lipídica, que culmina, por sua vez, na redução dos danos celulares causados pelo estresse oxidativo (JOHINKE; DE GRAAF; BATHGATE, 2014). No entanto, dependendo da concentração, a quercetina pode proporcionar o aumento ou redução nos níveis de GSH nos oócitos. Somado a isso, os oócitos são, naturalmente, portadores de GSH endógena, a qual é encontrada em maior quantidade durante a fase de maturação, sobretudo em oócitos no estádio de metáfase II. Suas concentrações podem ser alteradas, dependendo do protocolo de sistema de cultivo celular in vitro adotado no laboratório (LIU; HOU; YAO, 2010). A concentração de 8 µM de quercetina reduziu os níveis de EROS, GSH e mitocôndrias ativas. Resultados semelhantes aos obtidos em nossos estudos foram observados em espermatozoides bovinos (TVRD et al., 2016), à medida que acrescentava quercetina aos diluidores de sêmen. Tais autores sugerem que, em concentrações elevadas, a quercetina diminui a atividade modulatória de Ca2+-ATPase, resultando no maior influxo de cálcio intracelular, culminado, por sua vez, em lesões celulares e na consequente disfunção mitocondrial, o que resulta, na diminuição de atividade mitocondrial e menor produção de EROS pela mitocôndria.Conclusões
Em conclusão, 4 µM de quercetina pode ser utilizado em substituição à cisteamina na maturação de oócitos caprinos. Todavia, 8 µM de quercetina é prejudicial à atividade mitocondrial do oócito caprino maturado in vitro.Gráficos e Tabelas