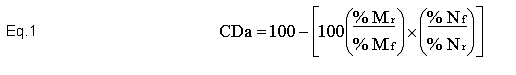Avaliação da sílica em ensaios de digestibilidade com tilápia do Nilo após extração assistida por ultrassom e determinação por espectrofotometria no visível
2 - UNESP/IBB/Botucatu
3 - UNESP/Botucatu
RESUMO -
Nos estudos de digestibilidade na nutrição animal, os marcadores externos são os mais utilizados, sendo o óxido de crômio (Cr2O3) o marcador que apresenta melhor aceitação. No entanto, o uso de marcadores externos apresenta problemática em detrimento das grandes quantidades administradas e divergências quanto a resultados de pesquisas. Além disso, o Cr2O3 é quantificado pelo método colorimétrico da difenilcarbazida e os extratos resultantes são soluções ácidas contendo íons dicromato. Este procedimento além de demorado, apresenta o inconveniente de oxidar o crômio (III) a crômio (VI), espécie altamente tóxica, que prejudica a saúde do analista e polui o meio ambiente. Em virtude disso, uma alternativa para eliminar esses problemas seria o uso de marcador interno, na forma de SiO2, que normalmente está presente nos ingredientes vegetais das rações comerciais e experimentais utilizadas em ensaios de digestibilidade com peixes e adotar extração por ultrassom no preparo das amostras (uma vez que essa técnica não exige mineralização ácida e portanto, por não oxidar o crômio (III) a crômio (VI), não é poluente) e quantificação por espectrofotometria UV-Vis, método alternativo à absorção atômica e mais acessível economicamente. Os resultados obtidos demonstraram que 3 ciclos de 10 s a 102 W foram suficientes para extração ultra-sônica dos minerais e dos marcadores. Já em relação à comparação entre os coeficientes de digestibilidade aparente utilizando Cr2O3 e SiO2, os resultados mostraram-se concordantes (P>0,05), no entanto para que efetivamente a sílica possa ser alternativa à utilização do óxido de crômio é importante que mais estudos sejam feitos considerando diferentes ingredientes vegetais e a variação natural da sílica nessas fontes.
Evaluation of silicon oxide in Nile tilapia digestibility assays after ultrasonic assisted extraction and determination by UV-Vis spectrophotometry
ABSTRACT - In animal nutrition digestibility studies, external markers are the most used and, chromium oxide (Cr2O3) is the most accepted marker. However, the use of external markers presents problematic due to large quantities administered to obtain adequate analytical results and divergences regarding the results of research, mainly due to the analytical variabilities. In addition, Cr2O3 is quantified by the colorimetric method of diphenylcarbazide and the extracts are acidic solutions containing dichromate ions. This procedure is time-consuming and, it has the disadvantage of oxidizing chromium (III) to chromium (VI), a highly toxic specie that is a risk for analyst’s health and pollutes the environment. Therefore, an alternative to eliminate these problems would be the use of internal marker, as SiO2, which is normally present in vegetable ingredients used in commercial and experimental diets in fish digestibility assays, applying ultrasonic extraction in samples’ pre-treatment (since this technique does not require acid mineralization because does not oxidize chromium (III) to chromium (VI) and it is not polluting) and the quantification by UV-Vis spectrophotometry, an alternative method to atomic absorption spectrometry (AAS), and economically accessible. The results showed that 3 cycles of 10 s and 102 W were sufficient for ultrasonic extraction of analytes (Ca, Mg, Zn and P) and markers. The comparison between the apparent digestibility coefficients using Cr2O3 and SiO2 was in accordance (P>0.05). However, for SiO2 to be a substitute to Cr2O3, it is important that more studies are carried out, considering different plant ingredients and the silicon oxide’s natural variation in these feed sources.Introdução
A avaliação do valor nutricional dos alimentos geralmente é realizada por meio de análise bromatológica e/ou por ensaios através da determinação do coeficiente de digestibilidade do(s) nutriente(s) de uma ração ou ingrediente (RINGO, 1993). A digestibilidade na teoria expressa o real aproveitamento do nutriente pelo animal, através da determinação do total deste nutriente ingerido e excretado nas fezes. Porém, em virtude das secreções endógenas como as secreções biliares, enzimáticas e descamações do epitélio, somente uma parte deste nutriente encontrado nas fezes é proveniente do alimento testado. Dessa forma, a determinação da digestibilidade de um nutriente sem considerar as perdas endógenas é chamada de digestibilidade aparente (BOMFIM & LANNA, 2004). Na determinação da digestibilidade aparente de um nutriente podemos utilizar as gaiolas metabólicas (método direto ou coleta total de fezes) ou usar marcadores (método indireto ou coleta parcial de fezes) que se dividem em internos, quando ocorrem naturalmente nos alimentos e em externos, quando são adicionados à dieta. Este último permite uma maior facilidade na condução dos ensaios, principalmente quando são feitos com peixes, já que a porcentagem da digestibilidade do nutriente pode ser avaliada sem a necessidade de determinar a quantidade de ração consumida e de fezes produzidas (AUSTRENG, 1978).Revisão Bibliográfica
Dentre os principais fatores que afetam os coeficientes de digestibilidade dos alimentos para peixes destacam-se a metodologia utilizada para a coleta de fezes, espécie, idade do peixe, composição do alimento, salinidade, temperatura da água e o tipo de processamento do alimento. Esses fatores são de grande importância na formulação de dietas balanceadas que maximizem a eficiência alimentar e o desempenho animal, além de minimizar a lixiviação de nutrientes para o meio (BOMFIM & LANNA, 2004). Uma substância ou um composto, para ser considerado um marcador em ensaios de digestibilidade, deve satisfazer os seguintes pré-requisitos: não interferir no metabolismo digestório do animal ou com a microflora intestinal, não ser absorvido ou metabolizado e ser atóxico (KABIR et al., 1998). No entanto, o uso de marcadores externos apresenta uma problemática em detrimento das grandes quantidades administradas para a obtenção de resultados analíticos adequados e divergências quanto a resultados de pesquisas, principalmente devido às variabilidades analíticas encontradas (KOZLOSKI et al., 1998; UDEN et al., 1980), uma vez que os coeficientes de digestibilidade são determinados pela relação entre a porcentagem de marcador encontrada na dieta e nas fezes, qualquer equívoco na determinação do marcador, especialmente na dieta, acarreta uma grande discrepância no cálculo final do coeficiente de digestibilidade (SAHA & GILBREATH, 1991). Em virtude do exposto anteriormente, uma opção de marcador interno de digestibilidade seria o silício, na forma de SiO2. Este elemento químico é um metalóide do grupo IV, que só perde em abundância para o oxigênio. A grande maioria das rochas, solos, areias e terras são compostos por silício ou por várias formas de sílica pura ou impura (quartzo, sílex, tridimita, ágata, opala) ou de silicatos, tais como feldspatos, micas, estando também presente na grande maioria das plantas, principalmente nas tropicais e na poeira atmosférica em suspensão (RUSSELL, 2008). Nos estudos de digestibilidade na nutrição animal, os marcadores externos são os mais utilizados, sendo o óxido de crômio (Cr2O3) o marcador que apresenta melhor aceitação (HANLEY, 1987; KANE et al., 1979). A determinação da porcentagem de Cr2O3 nas fezes dos peixes permite estimar o coeficiente de digestibilidade total ou parcial dos nutrientes metabolizados, comparando-se com a porcentagem desse óxido misturado inicialmente na ração (De La NOÜE & CHOUBERT, 1986). A quantificação do óxido de crômio nas rações e fezes apresenta dificuldades nos procedimentos de preparo das amostras. Normalmente, a mineralização das amostras é feita por aquecimento lento em blocos digestores utilizando a mistura nítrica-perclórica. Os extratos resultantes são soluções ácidas contendo íons dicromato que, normalmente são quantificados pelo método colorimétrico da difenilcarbazida (MARCZENKO, 1976). Este procedimento além de demorado, apresenta o inconveniente de oxidar o crômio (III) a crômio (VI), espécie altamente tóxica (GORSUCH, 1970). Considerando o exposto, o desenvolvimento de novas metodologias que permitam a quantificação segura dos compostos utilizados como marcadores de dietas para determinação da digestibilidade aparente nos estudos de nutrição animal torna-se fundamental. Neste contexto, a extração da sílica por ultrassom e sua determinação por espectrofotometria no visível apresenta-se como uma metodologia de estudo bastante promissora, principalmente porque permite a eliminação da etapa de mineralização das amostras, o que pela metodologia clássica utilizada constitui-se no principal problema. Além disso, visa o desenvolvimento de um protocolo analítico alternativo à espectrometria de absorção atômica e mais viável economicamente, de forma a possibilitar a determinação de SiO2 em soluções aquosas de amostras de rações e fezes de peixes.Materiais e Métodos
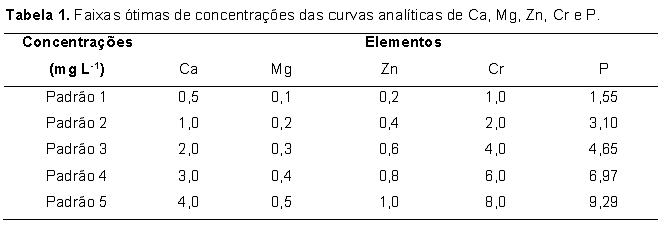
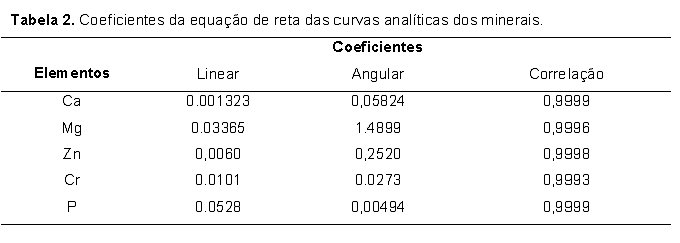
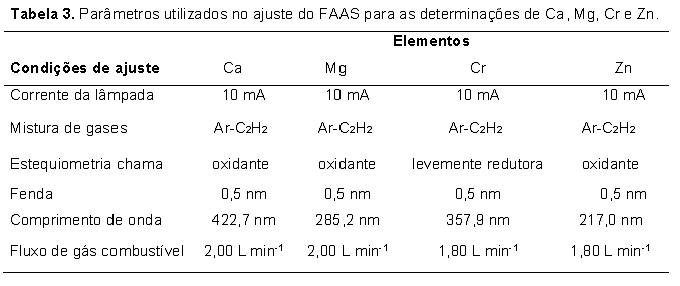
Reagentes e soluções Água ultrapura (18,2 MΩ cm-1) obtida pelo sistema Elga Ionic, modelo Purelab Option (Veolia Water Technologies, UK) foi utilizada em todo o trabalho. As soluções padrão de silício foram preparadas por diluições de padrão titrisol Merck e as soluções dos concomitantes e dos demais analitos (Ca, Mg, Zn e P) foram preparadas a partir de reagentes de pureza espectroscópica (Johnson & Matthey, Hertfordshire, UK). As demais soluções utilizadas, incluindo as soluções ácidas utilizadas nas mineralizações das amostras foram todas de grau analítico. Todas as soluções foram estocadas em frascos de polipropileno. Todos os frascos para estocagem de amostras e soluções padrão, cubetas de quartzo do espectrofotômetro e vidrarias foram lavados com ácido nítrico 10% v/v por 24 h, em seguida, com água ultrapura e secos por jatos de ar puro antes de sua utilização.Para reação com o silicato presente nas amostras pelo método do anidrido silicomolíbdico azul, preparou-se solução de molibdato de amônio hidratado a 10% (m/v), solução de HCl 6 mol L-1, solução de ácido oxálico 10% (m/v) e solução do ácido aminonaftolsulfônico (preparado a partir da pesagem de 0,5 g que foi solubilizado em 50 mL de solução contendo 1,0 g Na2SO3 e, posteriormente, misturado com 200 mL de solução contendo 30,0 g de bissulfito de sódio). Preparo das amostras As amostras de rações e fezes de peixes foram coletadas de ensaios realizados pelo grupo de pesquisa do laboratório de nutrição de peixes da UNESP/FMVZ/Botucatu, onde 0,1% de óxido de crômio foi adicionado às rações experimentais. As amostras foram submetidas à secagem em estufa de circulação forçada de ar (Marconi, modelo MA-035/5, Piracicaba, Brasil) a 50°C por 48 horas. Dessa forma, massa de 1,0 g das amostras foi moída utilizando moinho criogênico (SPEX SamplePrep Geno/Grinder, modelo 2010, Metuchen, USA) regulado para 4 ciclos de 6 min em 1000 rpm de rotação a -196oC. Este procedimento permitiu a obtenção de partículas com granulometria menor que 60 micrômetros. Mineralização das amostras Após a etapa de secagem e moagem, parte das amostras foi mineralizada utilizando blocos digestores (Marconi, modelo MA-447/6/100, Piracicaba, SP, Brasil) de capacidade para 6 balões de borosilicato de fundo redondo. Para isso, 100 mg de amostras (rações e fezes) foram transferidos para balões de Kjeldahl de 100 mL, adicionando em seguida alíquotas na proporção de 3,0 mL de solução concentrada de ácido nítrico 65% Merck e 1 mL de peróxido de hidrogênio 30% m/m Merck para auxiliar na completa oxidação da matéria orgânica. Posteriormente, alíquota de 1 mL de ácido perclórico 70% Merck foi adicionada para que os íons Cr (III) fossem oxidados a Cr (VI). Os extratos ácidos obtidos após total mineralização das amostras foram transferidos para balão volumétrico de 50 mL e o volume acertado com água ultrapura. Em cada mineralização foi preparado um branco que continha todos os reagentes utilizados na mineralização ácida das amostras, exceto a amostra em questão. Extração ultra-sônica dos analitos Após a etapa de secagem e moagem, 200 mg das amostras (rações e fezes) e 20 mL de solução contendo 18 mL de água ultrapura e 2 mL de surfactante Triton X-100 0,01% (Carlo Erba, Itália) foram transferidos para frascos de teflon de 50 mL. A mistura amostra/solução foi então submetida à agitação por ultrassom em disruptor de células ultra-sônico (UNIQUE, modelo USC-DC, Campinas, SP, Brasil) equipado com sonda de titânio de 3 mm. A eficiência do processo de extração por ultrassom nas amostras foi avaliada variando o tempo de agitação ultra-sônica (5, 10, 20, 40 e 60 s) e a potência (34, 68, 102, 136 e 204 W). Em cada tempo foram utilizados cinco ciclos de agitação. Os extratos obtidos foram separados da fase sólida remanescente por ultracentrifugação (Hettich Lab., modelo Universal-320R, Tuttlingen, Alemanha) a 3500 rpm por 5 min para posteriores determinações [concentração da sílica e fósforo por espectrofotometria UV-Vis e de crômio, cálcio, magnésio e zinco por espectrometria de absorção atômica, módulo chama (FAAS)]. Preparo da curva analítica de sílica A determinação de sílica nas amostras de rações e fezes foi feita pelo método espectrofotométrico anidrido silicomolíbdico azul, onde o complexo anidrido silicomolíbdico de cor azul esverdeado absorve radiação visível em 610 nm (comprimento de onda correspondente à cor alaranjada, complementar à cor azul esverdeada do complexo), sendo a intensidade da radiação absorvida pelo complexo proporcional à quantidade de SiO2 presente nos extratos ácidos. Alíquotas de respectivamente 0,00; 2,00; 4,00; 8,00; 16,00 e 20,00 mL de solução estoque de silicato de sódio (Na2SiO3) a 50 mg L-1 foram transferidas para balão volumétrico de 50 mL. Dessa forma, as concentrações finais (equivalentes estequiometricamente às de Si) foram respectivamente de 1,07; 2,14; 4,28; 6,42 e 8,56 mg L-1 de SiO2. A seguir, acrescentou-se 2 mL de solução de molibdato de amônio a 10% e, em seguida, 1 mL de solução 6 mol L-1 de ácido clorídrico, aguardando reação por cinco minutos. Posteriormente, alíquota de 5 mL de solução a 10% de ácido oxálico foi adicionada, aguardando em seguida, dois minutos. Na sequência, acrescentou-se 2 mL de ácido aminonaftolsulfônico e o volume foi completado com água ultrapura. Após homogeneização, aguardou-se 15 minutos para proceder às leituras de absorbância dos padrões de SiO2 em espectrofotômetro (Thermo Spectronic, modelo GenesysTM 6, Madison, USA). Os valores dos limites de detecção (LOD) e de quantificação (LOQ) calculados considerando os desvios padrão de vinte leituras do branco da curva analítica e o valor da inclinação da reta obtida (LOD=3xsd/slope e LOQ=10xsd/slope) (CURRIE, 1999) foram de LOD: 1,14 mg L-1 e LOQ: 3,79 mg L-1. Preparo de soluções padrão e curvas analíticas dos minerais As soluções padrão aquosas de Ca, Mg, Zn e Cr foram preparadas a partir de diluições de padrões titrisol (Merck) contendo 1000 mg L-1 dos analitos. As faixas ótimas de concentração das curvas de calibração são apresentadas na Tabela 1. Já a Tabela 2 apresenta os coeficientes linear, angular e de correlação das equações de reta das curvas analíticas dos minerais estudados. As determinações de Ca, Mg, Zn e Cr foram feitas por espectrometria de absorção atômica com módulo de chama (FAAS) equipado com corretor de absorção de fundo (lâmpada de deutério) e amostrador automático (ASC-6100). Lâmpadas de cátodo oco de Ca, Mg, Zn e Cr foram utilizadas, seguindo as recomendações do fabricante (AAS COOKBOOK, 2000), as quais encontram-se sumarizadas na Tabela 3. No preparo das soluções padrão aquosas de Ca e Mg foi preparada solução de lantânio 10 g L-1, sendo alíquota 10 mL da referida solução transferida para cada frasco dos padrões, de forma a evitar a formação de compostos insolúveis com o cálcio. As determinações de fósforo por espectrofotometria UV-Vis foram realizadas segundo o método do ácido vanadomolíbdico fosfórico (método amarelo), em comprimento de onda ajustado de máxima absorção a 420 nm. As condições operacionais utilizadas foram as descritas no manual do fabricante do equipamento Thermo Spectronic, modelo Genesis 6. No preparo da curva analítica do P, solução estoque de P a 38,72 mg L-1 foi preparada a partir de solução de KH2PO4 a 1,25 mmol L-1, sendo a faixa de concentração dos padrões de P fornecida na Tabela 1. Para cada curva analítica foi preparado um branco que continha todos os componentes das soluções padrão com exceção do analito de interesse. Cálculo dos coeficientes de digestibilidade dos minerais Após a obtenção dos valores em porcentagem dos referidos nutrientes (Ca, Mg, Zn e P) e das porcentagens dos dois tipos de marcadores (o interno – SiO2 e o externo – Cr2O3) foram feitos os cálculos dos coeficientes de digestibilidade aparente (CDa), considerando a equação matemática 1 (MAYNARD & LOOSLI, 1956). Análise estatística Os resultados foram submetidos à análise de variância (ANOVA) utilizando o procedimento PROC GLM do SAS (2008), sendo as médias comparadas pelo teste F (P<0,05).Resultados e Discussão
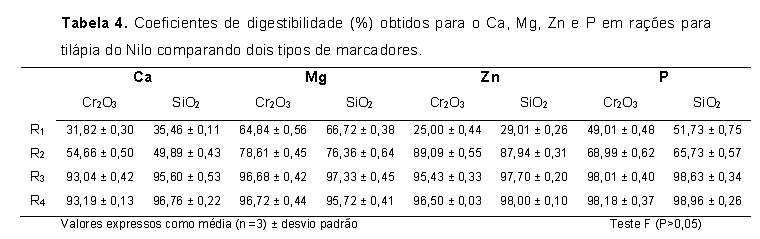
Na etapa de moagem da amostra foi obtida a menor granulometria possível, favorecendo a homogeneidade do analito e evitando possíveis erros associados à representatividade da amostra. A quantidade de amostra pesada (200 mg) foi utilizada considerando a concentração naturalmente presente de sílica no ingrediente utilizado na formulação das rações de juvenis de tilápia do Nilo. Como o efeito da utilização de concentrações ácidas com ácido clorídrico e nítrico testadas em estudos preliminares (SALEH et al., 2007) contribuiu para redução dos sinais de absorbância dos analitos nos extratos ácidos obtidos após a reação com o agente cromogênico, optou-se por usar solução contendo água ultrapura e surfactante Triton X-100 0,01%. As ondas ultra-sônicas além de favorecerem a homogeneidade da suspensão, promoveram a extração dos analitos da matriz, devido à atuação das ondas sobre as moléculas orgânicas presentes na amostra, diminuindo o tamanho destas ou mesmo destruindo-as e provocando a quebra da ligação do metal com essas moléculas, conforme observado também por SALEH et al. (2013); (2015). Os resultados demonstraram que 3 ciclos de 10 segundos de agitação ultra-sônica, utilizando 30% da potência máxima de trabalho, ou seja, 102 W foram suficientes para obter os melhores sinais de absorbância quando se analisou a sílica, assim como os minerais Ca, Mg, Zn e P nos extratos obtidos. Podemos observar pela Tabela 4 que os resultados dos CDa utilizando a sílica como marcador interno apesar de concordantes (P>0,05) com os resultados obtidos utilizando o óxido de crômio como marcador externo, de forma geral foram maiores que os obtidos com o óxido de crômio. Este comportamento pode estar relacionado à maior taxa de passagem promovida pela sílica no trato digestório das tilápias, corroborando resultados obtidos por De SILVA & PERERA (1983) em estudo com ciclídeo asiático (Etroplus suratensis), bem como com os de GODDARD & McLEAN (2001), em estudo com tilápia (Oreochromis aureus). Além disso, pode ser que a equação matemática utilizada não seja adequada para marcador interno, que apresenta concentrações variáveis na fonte alimentar. Portanto, mais estudos devem ser feitos para propor um modelo matemático que permita correlacionar diferentes tipos de marcadores de forma segura, considerando a proporção dos nutrientes na ração formulada e a da sílica nos ingredientes vegetais que compõem a ração.Conclusões
O método proposto de extração de sílica por ultrassom permitiu calcular os CDa de Ca, Mg, Zn e P em rações para juvenis de tilápia do Nilo, diminuiu consideravelmente o tempo de análise, o que favoreceu a velocidade analítica. Além disso, pelo método de extração por ultrassom, o óxido crômico adicionado às rações como indicador biológico inerte não é solubilizado e, conseqüentemente, o crômio (III) não é oxidado a dicromato (VI), espécie química extremamente tóxica, em contraste com a mineralização nítrica/perclórica das amostras (metodologia clássica). Em relação à utilização da sílica como marcador interno, os resultados obtidos sugerem que mais estudos sejam desenvolvidos na nutrição animal, considerando a variabilidade máxima do teor de marcadores internos, como a sílica, nos ingredientes que compõem a ração, garantindo assim, que ela possa efetivamente ser uma alternativa à utilização do óxido de crômio. Além disso, os resultados reforçam a necessidade do desenvolvimento de estudos para propor modelo matemático que permita correlacionar diferentes tipos de marcadores utilizados nos experimentos de digestibilidade com peixes.Gráficos e Tabelas