Influência da inclusão de monensina e tanino sobre a digestibilidade in vitro da matéria seca do capim Marandu adubado ou não com nitrogênio
2 - UFMT
3 - UFMT
4 - UFMT
5 - UFMT
6 - UFMT
7 - UFMT
8 - UFMT
RESUMO -
Objetivou-se avaliar a influência da inclusão de monensina e tanino sobre a digestibilidade in vitro da matéria seca. Utilizou-se inoculo ruminal de dois bovinos nelore com aproximadamente 300 kg de peso corporal com canula ruminal, mantidosem pastejo de Urochloa brizantha cv. Marandu suplementados com uma mistura múltipla a 0,3 % do peso corporal. O arranjo fatorial foi 2×5 e utilizou-se Urochloa brizantha cv. Marandu (forragem adubada e não adubada com nitrogênio), quatro níveis de taninos (0, 2, 4 e 6 mg g MS-1) e monensina (0,02 mg g MS-1). Quando o substrato utilizado foi a forragem sem adubação a inclusão de tanino reduziu (P<0,05) a DMS48 comparado com a monensina. Independentemente do substrato, a inclusão de monensina reduziu (P<0,05) a DMS96 quando comparado ao controle e a inclusão de tanino. Taninos e monensina possuem capacidade de modular a fermentação ruminal, diminuindo a digestibilidade da MS.
Influence of the inclusion of monensin and tannin on the in vitro digestibility of the dry matter of Marandu grass fertilized or not with nitrogen
ABSTRACT - The objective of this study was to evaluate the influence of the inclusion of monensin and tannin on the in vitro digestibility of dry matter . Ruminal inoculum of two Nellore cattle with approximately 300 kg of body weight was used in the grazing of Urochloa brizantha cv. Marandu supplemented with a multiple blend at 0.3% of body weight. The factorial arrangement was 2x5 and two substrates of Urochloa brizantha cv. Marandu (forage fertilized and not fertilized with nitrogen), four levels of tannins (0, 2, 4 and 6 mg g MS-1) and monensin (0.02 mg g MS-1). When the substrate used was forage without fertilization the inclusion of tannin reduced (P <0.05) the DMD48 compared with monensin. Regardless of the substrate, the inclusion of monensin reduced (P <0.05) the DMD96 when compared to the control and the inclusion of tannin. Tannins and monensin have the ability to modulate ruminal fermentation, reducing the digestibility of DMIntrodução
De maneira geral, os antibióticos são utilizados largamente para tratamento de doenças infecciosas, mas também são frequentemente incluídos como aditivos alimentares para prevenir doenças bacterianas em animais sadios (uso profilático) ou melhorar a eficiência de crescimento (Clarck et al., 2012). Com a proibição do uso de ionóforos em 2006 pela União Europeia mediante a possibilidade de microrganismos resistentes e presença de resíduos químicos nos produtos de origem animal, (Tedeschi et al., 2011) tem se buscado portanto, produtos naturais que promovam efeitos semelhantes aos ionóforos antimicrobianos sem causar riscos à saúde, na qual salienta -se o uso de extratos de plantas e compostos do metabolismo secundário de plantas, particularmente os taninos (Hristov et al., 2013). Os Taninos condensados são polímeros de flavan-3-ols e flavan-3,4-diols unidos por ligações carbono-carbono; possuem estrutura complexa e são resistentes à hidrólise (Costa et al., 2008). Os Taninos hidrolisáveis são constituídos por fenóis simples, galotaninos e elagitaninos, que após hidrólise formam ácido gálico e ácido elágico. (Etuk et al., 2012). O presente trabalho teve como objetivo avaliar a influência dos níveis de taninos e monensina sobre a digestibilidade in vitro da matéria seca do capim Marandu.Revisão Bibliográfica
Os efeitos dos ionóforos sobre as bactérias ruminais é selecionar as Gram-negativas que são mais resistentes em virtude de sua célula ser constituída por uma membrana externa de proteção formada por proteínas, lipoproteínas e lipopolissacarideos nas quais representam as bactérias produtoras de ácido succínico e propiônico, já as Gram-positivas produtoras de ácido acético, butírico, lático, fórmico e de hidrogênio, por possuirem só uma camada espessa de peptidoglicanos e porosa, não impede a ação da monensina (Morais et al., 2011). Podemos destacar então um aumento da produção de propionato, diminuição da produção de acetato, metano, lactato, da concentração ruminal de amônia; redução da degradação proteica no rúmen e melhor aproveitamento da proteína no intestino; aumento do pH ruminal; em dietas de alto grão provoca redução de consumo, manutenção do ganho de peso e melhoria da conversão alimentar; já em dietas de baixo grão ocorre aumento de consumo ou não alteração, aumento de ganho de peso e estabilização de consumo ao longo do dia ( Graminha et al. 2012). Os taninos quando administrados em níveis adequados podem exercer efeitos benéficos na utilização de nutrientes reduzindo a quantidade de proteína digerida no rúmen, aumento na quantidade de proteína disponível no intestino delgado, eliminação de parasitas e diminuição do timpanismo espumoso (Mueller-Harvey, 2010). Afetam a digestibilidade da dieta ao formar complexos com proteínas, carboidratos, macromoléculas e outros polímeros, precipitando os, o que leva dietas ricas em taninos provocarem efeitos inibitórios sobre a atividade biológica de várias enzimas como tripsina, α-amilase, β-glucosidase, lipase, entre outras (Coelho, 2007). Os efeitos dos taninos são dose dependente, sendo que resultados negativos ocorrem quando ingeridos em alta quantidade, acima de 6% da MS (Coelho, 2007).Materiais e Métodos
O experimento foi conduzido no Laboratório de Nutrição Animal da Faculdade de Agronomia e Zootecnia – FAAZ da Universidade Federal de Mato Grosso, no mês de agosto de 2016. Ocorreu durante quatro semanas consecutivas em arranjo fatorial 2x5, utilizando -se dois substratos (forragem adubada e não adubada com nitrogênio), quatro níveis de taninos (0, 2, 4 e 6 mg g MS-1) e monensina (0,02 mg g MS-1). O tanino foi obtido a partir de uma mistura (Silvafeed-Bypro®, Silvateam-Inudor S.A., Argentina) e a monensina (Rumensin®Elanco, 20%). O substrato incubado foi a Urochloa brizantha cv. Marandu, proveniente de um estudo anterior em que a cada ciclo de corte as parcelas adubadas recebiam 100 kg de N/ha de sulfato de amônio a 21%, nas quais as amostras utilizadas foram obtidas no quinto corte (maio de 2016). O fluído ruminal foi colhido de dois bovinos Nelore machos inteiros com 300 kg ± 25 kg de peso corporal portando cânulas ruminais, suplementados com uma mistura múltipla a 0,3 % do peso corporal diariamente em um piquete formado por Urochloa brizantha cv. Marandu. Foram adicionados aos frascos 40 mL de solução tampão McDougal (1949), pipetado 0,2 mL do aditivo tanino diluído em água destilada aquecida (60ºC) e a monensina em álcool etílico absoluto P.A, trinta minutos depois foi adicionado 10 ml de líquido ruminal; 0,5 g de cada substrato-forragem adubada ou sem adubação, dispostos aleatoriamente no banho-maria com agitação orbital. Para determinação da digestibilidade in vitro da matéria seca (DMS), os frascos foram retirados nos tempos de 24 horas (DMS24), 48 horas (DMS48) e 96 horas (DMS96). O conteúdo de cada frasco foi colocado em sacos ankom® F57 (Ankom Technology Corp. Macedon, NY) e colocados em estufa a 105 ºC por 16 horas conforme descrito por Detmann et al. (2012) a fim de avaliar a DMS24, DMS48 ou DMS96. As variáveis foram analisadas utilizando o procedimento MIXED do SAS (versão 9,3), sendo significativa, foram declaradas a P (<0,05).Resultados e Discussão
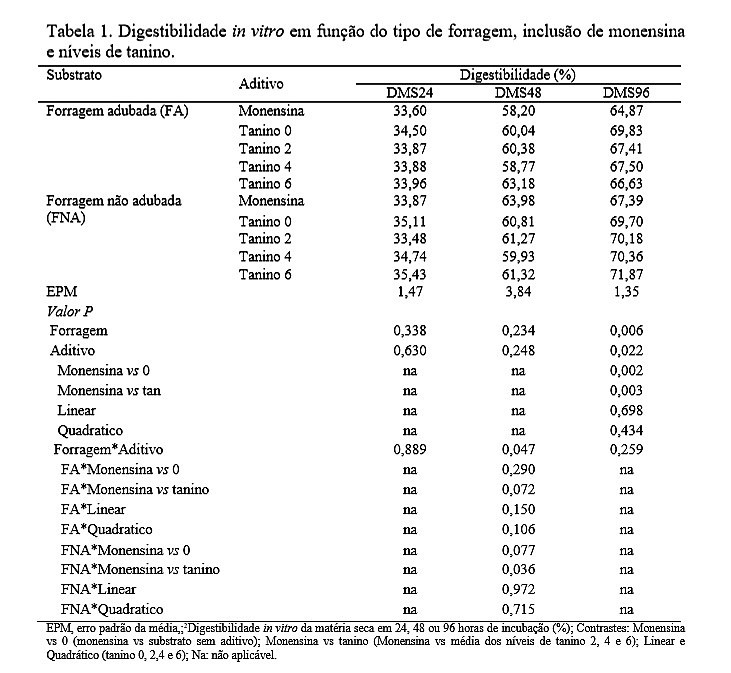
A forragem sem adubação aumentou (P<0,05) a digestibilidade da MS após 96 horas de incubação em relação à forragem adubada. Independentemente do substrato, a inclusão de monensina reduziu (P<0,05) a DMS96 quando comparado ao controle e a inclusão de tanino (Tabela 1). Dentre os vários autores da literatura em diferentes graus e de diversos nutrientes podemos citar Salles & Lucci, (2000) que têm comprovado melhora na digestibilidade quando a monensina é oferecida a ruminantes. Entretanto, neste experimento, a monensina reduziu a digestibilidade, que pode ser entendida como a capacidade da monensina em inibir alguns dos microrgranimos fibrolíticos (e.g. Ruminococcus albus, Ruminococcus flavefaciens e Butyrivibrio fibrisolvens) (Chen e Wolin, 1979). Houve interação forragem x aditivos (P<0,05) para digestibilidade da MS em 48 de incubação. A inclusão de tanino reduziu (P<0,05) a DMS48 comparado com a monensina quando o substrato utilizado foi a forragem sem adubação (Tabela 1). Esse efeito pode ser atribuído à ação inibitória sobre a atividade das enzimas e microrganismos (Coelho, 2007). Estudos feitos por Carulla et al. (2005) observaram que a suplementação na dieta de ovinos com 2,5 % de tanino condensado diminuiu a digestibilidade da MO, PB e FDN. Assim como os resultados encontrados por Lenmüller et al. (1991) em estudos in vitro em que ocorreu a diminuição a digestibilidade da matéria seca.Conclusões
A inclusão de monensina e tanino no capim Marandu reduzem a digestibilidade da matéria seca in vitro.Gráficos e Tabelas