Adição do colesterol carregado pela ciclodextrina no sêmen do garanhão da raça Nordestina sobre a integridade da membrana espermática
2 - Universidade Estadual do Ceará
3 - Universidade Estadual do Ceará
RESUMO -
Objetivou-se avaliar o efeito da adição de colesterol no sêmen de garanhões da raça Nordestina sobre a funcionalidade da membrana dos espermatozoides descongelados. Vinte ejaculados de dois garanhões foram diluídos com BotuSemen e colesterol carreado pela ciclodextrina (CCC) adicionado no sêmen (controle: 0,75 e 1,0mg de CCC/120×106 sptz/mL) e mantido a 26°C/15min, para depois diluír 1:5 com Lactose-gema e resfriado a 5°C/2h, envasado em palhetas (0,5mL) e acondicionado sob vapor de nitrogênio líquido, e depois imergidos. As amostras foram descongeladas (37°C/30s) e parâmetros analisados pela ANOVA e médias comparadas pelo teste de Tukey (P<0,05). O CCC promoveu maior percentual de motilidade durante as 3 horas de incubação. O número de espermatozoides reativos ao teste hiposmótico foi maior nos tratados com CCC comparado ao controle. Adição de colesterol no sêmen de garanhão Nordestino mantém o percentual de motilidade espermática elevada ao longo das 3h de incubação e a integridade da membrana plasmática.
Addition of cholesterol-loaded cyclodextrin on membrane integrity of the stallion of the Northeastern breed
ABSTRACT - The objective was evaluate the effect of adding cholesterol in the semen of Nordestina stallion breed on the longevity of thawed spermatozoa. Twenty semen samples were used from two stallions, diluted with BotuSemen diluent and cholesterol add as follows: control, 0.75 mg of CCC and 1.0 mg of CCC/120x106 sperm/mL, and incubated for 15 min at 22°C. The samples were diluted 1:5 with lactose-yolk egg diluent and cooled to 5°C over a two hours, packaged into 0.5 mL straws and frozen in static liquid nitrogen vapor before being plunged into nitrogne. Samples were thawed (37°C/30s) and analyzed. The variables were analyzed by ANOVA and means compare by Tukey test (P<0.05). The number of spermatozoa reacted to hypoosmotic test was higher (P<0.05) in sperm treated with CCC than control. Addition of cholesterol in semen of stallion Northeastern maintains the percentage of sperm motility high during the 3h incubation and preserve the membrane integrity.Introdução
Pesquisas tem demonstrado que a incorporação do colesterol na membrana espermática, protege a célula espermática durante o resfriamento, além de reduzir os danos celulares decorrentes da criopreservação (MORAES et al., 2015; SOUZA et al., 2016a). Adicionalmente, o colesterol também promove à estabilização e modulação da fluidez da membrana a temperatura corpórea (LEE et al., 2015; YILDIZ et al., 2015). Os espermatozoides de equinos possuem menor relação colesterol:fosfolipídios e maior relação proteínas:fosfolipídios, o que acarreta maior sensibilidade aos danos causados pelo resfriamento (MORAES et al., 2010). Estas características da membrana do espermatozoide equino aumentam a probabilidade de ocorrer perturbações resultantes do resfriamento e alteração nas interações entre os lipídios e proteínas, tornando-a mais sensível ao resfriamento que da espécie bovina (MORAES et al., 2010). No entanto, pesquisas tem demonstrado que a incorporação do colesterol na membrana espermática, protege a célula espermática durante o resfriamento, além de reduzir os danos celulares decorrentes da criopreservação (MORAES et al., 2015; SOUZA et al., 2016). Adicionalmente, o colesterol também promove à estabilização e modulação da fluidez da membrana a temperatura corpórea (LEE et al., 2015; YILDIZ et al., 2015). Diante disso, este estudo teve como objetivo avaliar o efeito da adição de colesterol no sêmen de garanhões da raça Nordestina sobre a integridade da membrana plasmática dos espermatozoides após descongelamento.Revisão Bibliográfica
A raça Nordestina se caracteriza, principalmente, pela rusticidade, sobriedade, rigidez muscular, porte pequeno e bem proporcionado, cascos duros que dispensam o uso de ferraduras, temperamento sociável e amistoso, fácil adaptação ao meio e ao processo de criação (LEE et al., 2015; YILDIZ et al., 2015). Utilizada, principalmente, na lida com o gado é uma raça moldada pela aridez e deficiências da região Nordeste do Brasil, pois pode viver com pouco alimento, de modo grosseiro e bebendo pouca água. A despeito destas condições e de sua pequena estatura, magreza e aparência resignada, trabalha bem viajando grandes distâncias (ENCICLOPÉDIA, SD). É, portanto, insubstituível em seu ambiente natural, a caatinga agressiva, onde presta relevantes serviços à economia da região, não só transportando cargas, como também pessoas. Para este fim a inseminação artificial (IA) é a biotécnica reprodutiva de eleição, pois propicia a seleção de reprodutores de alto valor genético e o ganho genético (ALMEIDA, 2006). Associada à criopreservação do sêmen, a IA representa uma importante ferramenta na preservação da raça equina, tanto pela maximização do uso de reprodutores superiores como pela formação de um banco genético disponível por tempo indeterminado (SAMPER; HANKINS, 2001). Entretanto, variações quanto a certos aspectos do sêmen congelado/descongelado, descritas em várias raças equinas (ALVARENGA et al., 2003), é um entrave a disseminação da técnica e têm inclusive levado à classificação dos garanhões como “resfriadores bons” ou “resfriadores ruins” segundo a susceptibilidade do ejaculado à criopreservação (BRINSKO et al., 2000; BATELLIER et al., 2001; CARMO; ALMEIDA, 2006). A ausência de seleção genética para características de fertilidade e resistência espermática à congelação como de fatores biofísicos e bioquímicos característicos dos espermatozóides parecem ser os responsáveis pelos insucessos observados na espécie equina (SAMPER; HANKINS, 2001; VARNER, 2003; LOOMIS; GRAHAM, 2008).Materiais e Métodos
Aspectos Éticos O presente estudo foi realizado após a aprovação institucional da Universidade Federal do Vale do São Francisco (Univasf), sob o protocolo nº 0006/161012. Local de execução O experimento foi realizado no Centro de Pesquisa em Suínos, Espécies Nativas e Silvestre (CPSENS), localizados no Campus de Ciências Agrárias da Univasf, situados no munícipio de Petrolina-PE. Preparo do colesterol O colesterol carregado com ciclodextrina foi preparado como descrito por Moraes et al. (2010). Brevemente, 200 mg de colesterol foram dissolvidos em 1 mL de clorofórmio e 1 g de metil-β-ciclodextrina dissolvido em 2 mL de metanol. Em seguida, alíquota de 0,45 mL da solução de colesterol foi adicionada à solução de ciclodextrina e agitada até a combinação das soluções ficarem clara. A solução resultante foi colocada em placa de petri de vidro para remoção dos solventes, por meio do fluxo de gás de nitrogênio com pureza mínima de 90%. Logo após, os cristais resultantes foram colocados para secar em placa aquecedora por 24 horas, e decorrido este tempo, foram estocados em tubos de vidro a 22 °C. A solução de trabalho de colesterol carregado com ciclodextrina (CCC) foi preparada pela adição de 50 mg de CCC em 1 mL do TALP a 37 °C e homogeneizada por agitação com auxílio do agitador de tubos. Animais Foram utilizados dois garanhões da raça Nordestina, com idade média de 9,5 anos, selecionados através de exame andrológico. Os garanhões foram mantidos em baias individuais, sendo clinicamente sadios e provenientes da Fazenda da Associação Brasileira de Criadores do Cavalo Nordestino, localizada em Juazeiro, BA (09°25’00” de latitude S; 40°30’00” de longitude O). Coleta e processamento do sêmen Após 72h do esgotamento dos garanhões, iniciou-se a coleta do sêmen para análise, realizando-se duas coletas por semana para cada garanhão (n=20). Após cada coleta, o ejaculado foi filtrado com auxílio do filtro de nylon e o volume determinado por visualização direta em Tubo Falcon graduado. Logo após, foi realizada a diluição do sêmen (1:1) com diluidor de transporte (BotuSêmen®, Biotech), e o ejaculado foi transportado em uma caixa térmica para o CPSENS, mantido em banho-maria a 35 °C, No CPSENS, a concentração espermática foi determinada utilizando um fotômetro (Spermacue®, Minitub). Então, o sêmen foi homogeneizado e submetido à centrifugação em tubos cônicos (50 mL) a 400 g por 7 minutos. Após a centrifugação, o sobrenadante foi descartado e os peletes resultantes da centrifugação foram ressuspendidos no diluidor de congelação (BotuCrio®, Biotech), pré-aquecido a 35 °C, para a concentração de 120 x 106 sptz/mL e avaliados quanto às motilidades total (MT) e progressiva (MP) utilizando o sistema de análise computadorizada (CASA®, Minitub, Berlin, Alemanha). Ejaculados com menos 70% de MT foram descartados. Para determinação dos tratamentos experimentais, o CCC foi adicionado ao sêmen diluído, estabelecendo os tratamentos: controle (sem adição do CCC), 0,75 mg de CCC e 1,0 mg de CCC/120 x 106 sptz/mL. Logo após, as amostra foram retiradas do banho maria e mantidas a 22 °C, por 15 min, para iniciar a curva de congelação. Após esse período, o sêmen foi diluído 1:5 (v/v) com diluente Lactose-Gema de ovo e acondicionadas em câmara fria a 5 °C por duas horas. Depois, as amostras de cada tratamento foram envasadas em palhetas de 0,5 mL e lacradas com seladora (UltraSeal®, Minitub) e acondicionadas sob vapores do nitrogênio liquido, por 10 minutos (-60 °C/min). Decorrido este tempo, as palhetas foram imersas no nitrogênio líquido (-196 °C) e estocadas em botijão criogênico para posterior análise. A descongelação foi realizada mergulhando-se as palhetas com as amostras de sêmen no descongelador automático por 30 segundos a 37 °C. Os espermatozoides descongelados foram submetidos ao teste de termo resistência (TTR) para avaliação da longevidade após descongelação. A avaliação consistiu no acondicionamento de 1,0 mL de cada amostra em microtubo de 1,5 mL no banho maria a 37 °C por 180 minutos. Onde 10 μL de cada microtubo foi retirado a cada 30 minutos (0, 30, 60, 90, 120, 150 e 180 min) para avaliação da motilidade total e progressiva no CASA (SOUZA et al., 2016). Para avaliação da funcionalidade da membrana plasmática utilizou-se o teste hiposmótico (HOST) em câmara úmida, como descrito recentemente por Martins et al. (2011). Para tanto, amostras de 100 μL foram adicionadas em microtubo de 1,5 mL e diluídas com 100 µL da solução hiposmótica constituída por partes iguais de citrato tri-sódico e frutose obedecendo a concentração de 125 mOsm/L. Logo após, as amostras diluídas foram incubadas em banho maria por 60 min a 37 °C. Transcorrido esse tempo, as amostras foram formolizadas em solução de formol-salina tamponada na proporção de 10:1, sendo então estocadas em microtubo de 1,5 mL para posterior avaliação. Para avaliação, foram depositados 10 µL da solução incubada sobre lâmina, coberta com lamínula para proceder à contagem de 200 sptz/lâmina/tratamento, utilizando microscópio óptico com contraste de fase em aumento de 400x. As variáveis foram submetidas à análise de variância e as médias comparadas pelo teste de Tukey a 5% de probabilidade utilizando-se o programa SAS 9.2 2002-2008 by SAS Institute Inc., Cary, NC, USA.Resultados e Discussão
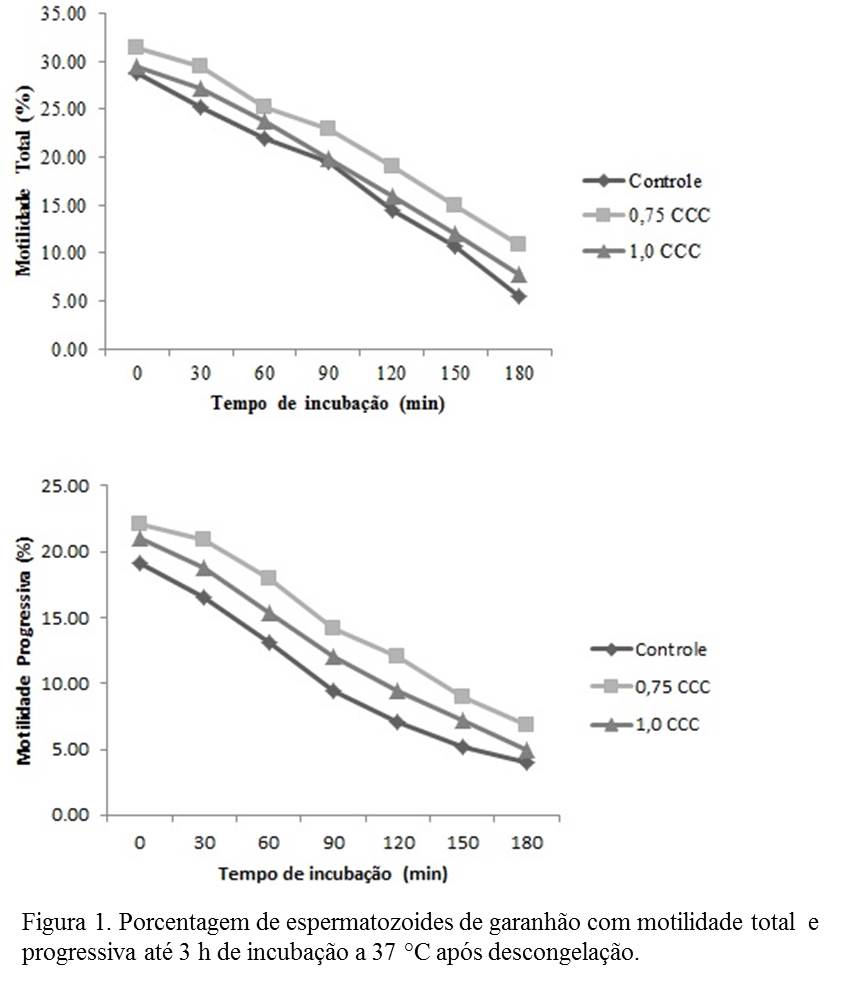
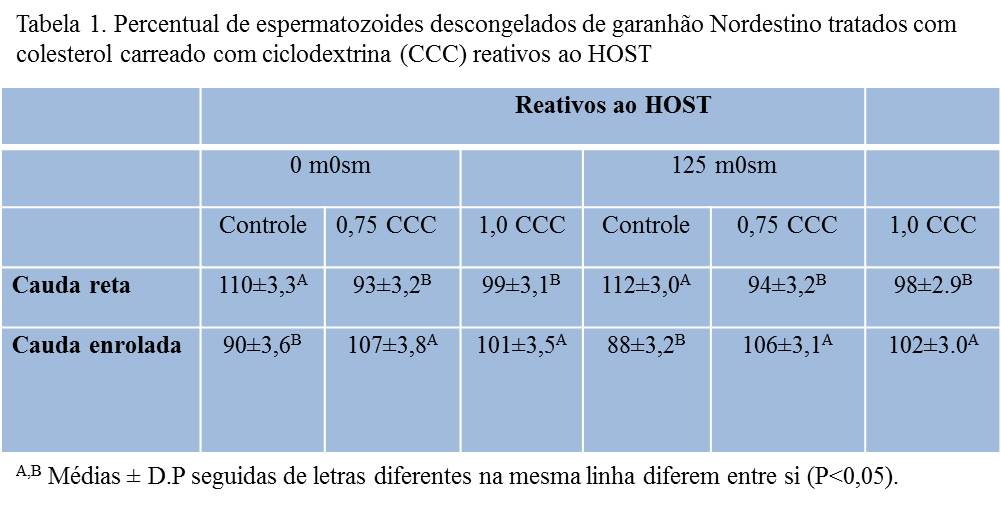
Os espermatozoides tratados com 0,75 mg de colesterol carreado com ciclodextrina antes da criopreservação, apresentaram maiores percentuais de motilidade total e progressiva durante as 3 horas de incubação, quando comparado aos demais tratamentos (Figura 1; P<0,05). Na avaliação da funcionalidade da membrana plasmática, observa-se que o número de espermatozoides reativos ao HOST, após o processo de congelação/descongelação foi maior naqueles tratados com 0,75 mg de CCC quando comparado ao grupo tratado com 1,0 mg de CCC e o controle (Tabela 1; P<0,05).Conclusões
A adição do colesterol carreado com ciclodextrina ao sêmen diluído, antes da criopreservação, manteve o percentual de motilidade espermática elevada ao longo das 3h de incubação e apresentou efeitos benéficos sobre a conservação da membrana plasmática dos espermatozoides de garanhão, protegendo-os das crioinjúrias durante o período de criopreservação.Gráficos e Tabelas