Associação da Quitosana e do Liquido da Castanha de Caju, como aditivos em dietas para ruminantes: Digestibilidade in vitro da matéria seca
2 - UFT
3 - UFGD
4 - UFGD
5 - UFGD
6 - UFGD
7 - UFGD
8 - UFGD
RESUMO -
Avaliou-se o pH e as concentrações de amônia (NAR) do liquido ruminal in vitro de dietas para ruminantes contendo líquido da casca da castanha de caju (LCC) e/ou quitosana (QUIT), de dietas compostas de cinco proporções de volumo: concentrado (100:00, 65:35, 50:50, 35:65, 20:80), com a adição de 500mg/kg de MS do LCC; 500 mg/kg de MS de QUIT; e associação da LCC + QUIT (500 mg/kg de MS + 500 mg/kg de MS), e 200 mg/kg de MS de monensina. Para determinar a digestibilidade in vitro da matéria seca (DIVMS), foi utilizado o rúmen artificial; em delineamento inteiramente ao acaso. Ocorreram efeitos para a adição dos aditivos (P<0,0001) e para as dietas (P<0,0001). A QUI apresentou médias para o coeficiente de DIVMS de 0,65, a monensina (0,60) e a adição de LCC e a associação entre LCC + QUIT, não diferiram estatisticamente com valores médios de 0,57. DIVMS apresentou comportamento linear crescente para o acréscimo de concentrado nas dietas. A associação do LCC com a QUIT reduziram a DIVMS.
Association of Chitosan and Cashew nut shell Liquid, as additives in diets for ruminants: In Vitro Dry Matter Digestibility
ABSTRACT - The objective of this work was to evaluate the pH and ammonia concentrations (NAR) on ruminal liquid, in vitro, of diets for ruminants containing cashew nut shell liquid (LCC) and/or chitosan (QUIT). The diets were composed of five roughage:concentrated ratio (100: 00, 65:35, 50:50, 35:65, 20:80). The additives used was 500mg/kg DM of the LCC; 500 mg/kg DM QUIT; and association of LCC+QUIT (500 mg/kg DM+500 mg/kg DM), and 200 mg/kg DM of monensin. To determine the in vitro dry matter digestibility (IVDMD), the artificial rumen. The treatments were distributed in a completely randomized design. Effects were observed for additives (P <0.0001) and diets (P <0.0001). Chitosan presented IVDDM coefficient of 0.65, followed by monensin (0.60); the addition of LCC and the association between LCC + QUIT, did not differ statistically (0.57). IVDMD showed increasing linear behavior for the addition of concentrate. The association of LCC with chitosan reduced the dry matter digestibility.Introdução
A utilização de aditivos alimentares é uma estratégia muito utilizada para prevenir o desenvolvimento de desordens digestivas, já que ajudam a manter o equilíbrio do ambiente ruminal, favorecendo o aproveitamento dos nutrientes da dieta. Aditivos como os ionóforos têm sido usados com sucesso inibindo o crescimento das bactérias produtoras de ácido lático, ajudando a regular o pH ruminal, além de controlar a produção de metano no rúmen, reduzindo o gasto de energia. Entretanto, existe a preocupação pela transferência horizontal de genes de virulência, desenvolvimento de micróbios patogénicos resistentes aos ionóforos e possíveis resíduos em produtos de origem animal. Portanto, é necessário a busca de aditivos alternativos que sejam capazes de produzir efeitos positivos sobre a fermentação ruminal. Desta forma, vem se estudando a potencialidade antimicrobiana de compostos naturais como a quitosana e o líquido da casca da castanha de caju (LCC) considerados aditivos alternativos que melhoram a fermentação ruminal e a digestibilidade total da dieta em animais ruminantes. A quitosana é um biopolímero natural, não tóxico, biodegradável, derivado da desacetilação de quitina, principal componente das conchas de crustáceos e insetos; apresenta atividade antimicrobiana podendo aumentar a proporção de propionato e diminuição da produção de metano, permitindo padrões de fermentação mais eficientes. O LCC é um óleo funcional, caracterizado por ser fonte natural de compostos de cadeia fenólica longa e insaturada. Por suas características químicas, pode influenciar positivamente a digestibilidade da dieta e induzir mudanças sobre os produtos finais da fermentação, assim como com a regulação do pH ruminal.Revisão Bibliográfica
O número e a distribuição da população microbiana no rúmen, os produtos da fermentação ruminal, a osmolaridade e o pH, dependem em grande parte da dieta consumida pelos animais (Valadares Filho e Santos Pina, 2011). Sendo assim, o balanço adequado dos nutrientes (proteína, carboidratos) podem influenciar na eficiência alimentar, a produtividade e a saúde dos animais. Assim, o uso de aditivos alimentares é utilizado como alternativa para potencializar o desempenho animal, melhorando os padrões de fermentação, estabilizando o pH ruminal, reduzindo desta forma, o impacto do uso das dietas alto grão. Além disso, pode reduzir as perdas energéticas resultantes do excesso da formação de metano (Berndt et al., 2007). Os principais aditivos utilizados no Brasil ainda são os ionóforos, uma vez que sua utilização na dieta dos ruminantes resulta em mudanças no ambiente ruminal que tornam o sistema produtivo mais eficiente. No entanto, os problemas com toxicidade e resistência bacteriana, impedem a utilização destes produtos como aditivos alimentares para os ruminantes em muitos países (Barton, 2000). Desta forma, alguns compostos de origem natural vêm sendo foco de estudos como alternativas aos ionóforos por apresentarem propriedades antimicrobianas, pelo que poderiam ser usados para manipular o ecossistema microbiano ruminal (Belanche et al., 2015). A quitosana é obtida por um processo de desacetilação de quitina, composto por unidades ß-1,4 D-glucosamina ligadas a resíduos de N-acetil glucosamina, os quais lhe conferem uma atividade antimicrobiana caraterística (Matsuhashi e Kume, 1997). Alguns trabalhos sugerem que a atividade antimicrobiana da quitosana é devido ao grupo amino presente na estrutura química da quitosana, a qual pode interagir com as cargas negativas da membrana celular das bactérias, causando mudanças na permeabilidade da membrana plasmática e perda de componentes citoplasmáticos (Helander et al., 2001; Kong et al., 2010). Na nutrição de ruminantes, a quitosana vem sendo estudadas como aditivo modulador da fermentação ruminal. Pesquisas in vitro como a realizada por Goiri et al. (2009) utilizando quitosanas com diferente grau de desacetilação e dose (0, 325, 750 e 1500 mg L-1 de fluido de ruminal) adicionadas em dietas com diferente razão volumoso: concentrado (80:20, 50:50 e 20:80), observaram que a quitosana aumentou linearmente as concentrações de propionato em todos os tratamentos. Por outro lado, Li et al. (2013) avaliando dietas com diferentes razoes volumoso: concentrado (80:20; 50:50 e 20:80) com adição de 0,33, 667 e 1000 mg L-1 de quitosana, encontraram mudança no padrão da fermentação ruminal, com redução da produção de metano. O LCC é um óleo funcional obtido a partir do processamento da castanha de caju (Anacardium occidentale L), considerado uma fonte natural de lipídios fenólicos, como o ácido anacárdico, o cardol e o cardanol (Kubo et al., 1993). A ação antibacteriana parece estar relacionada ao caráter anfipático dos lipídios fenólicos, os quais possuem alta afinidade pelas bicamadas lipídicas presentes nas membranas bacterianas. Uma vez incorporados às membranas celulares, os lipídios fenólicos danificam as proteínas da membrana, provocando aumento da permeabilidade da mesma e a fuga dos componentes citoplasmáticos, com consequente lise celular (Kubo e Himejima, 1991; Lima et al., 2000; Burt et al., 2004). Entre os efeitos observados na literatura com a adição de LCC na dieta de bovinos, destaca-se mudanças nas espécies bacterianas do rúmen bactérias, selecionando bactérias Gram-negativas e inibindo o crescimento das Gram-positivas, situação que favorece o aumento da produção de propionato e reduzem as concentrações de ácido acético, ácido lático e metano (Watanabe et al., 2010; Shinkai et al., 2012).Materiais e Métodos
O experimento foi realizado no e Laboratório de Nutrição Animal (LANA) da Universidade Federal da Grande Dourados, no município de Dourados – MS. Foram utilizados dois bovinos mestiços, castrados, com peso médio de 350 kg±, providos de cânula ruminal como doadores de inóculo ruminal. Os animais permaneceram em piquetes de capim U. brizantha cv Marandu. Os tratamentos consistiram em cinco relações volumoso com concentrado (100:00, 65:35; 50:50; 35:65 e 20:80) e quatro tipos de aditivos: monensina (controle); líquido da casca da castanha de caju (LCCC); quitosana em pó (Q); e líquido da casca da castanha de caju e quitosana (LCCCQ) nas proporções: 500mg/kg de MS do LCCC; 500 mg/kg de MS de Q; 200 mg/kg de MS de monensina; e 500 mg/kg de MS cada LCCC/Q. As dietas foram compostas de feno de Tifton 85 (Cynodon spp) como volumoso e, milho (49,72%), farelo de soja (40,05%) e suplemento mineral (10,23%) como concentrado, em todas as relações V: C. Para determinar a digestibilidade in vitro da matéria seca (DIVMS), foi utilizado incubadora in vitro TE - 150 - Tecnal®, onde foi acrescentado inóculo ruminal e solução tampão de acordo com a metodologia descrita por Tilley & Terry (1963) modificada por Holden et al. (1999) numa digestão realizada em dois estágios. As amostras dos tratamentos foram dispostas em saquinhos de TNT na medida 5,0 x 5,0 cm, conforme a metodologia utilizada por Casali et al. (2008). A incubadora suporta quatro jarros e cada um correspondeu a um aditivo, e recebeu 22 saquinhos (20 saquinhos contendo diferentes relações volumoso com concentrado e dois saquinhos brancos para correção dos dados). Os saquinhos com as amostras foram distribuídos aleatoriamente. Os aditivos foram pesados e adicionados diretamente nos jarros da incubadora, misturando aos saquinhos contendo as dietas. As coletas do líquido ruminal dos animais foram realizadas sempre pela manhã (8 horas). O material coletado era coado em gaze e armazenado em garrafas previamente aquecidas e mantidas a 39oC com fusão de CO2 e vedadas para serem transportados até o laboratório. Ao final da incubação in vitro, os saquinhos foram lavados em água corrente, e colocados em estufa de circulação forçada a 55º C por 12 horas para secagem. No dia seguinte, as amostras foram retiradas da estufa e pesados. A determinação da DIVMS, deu-se pela diferença entre a quantidade de matéria seca incubada (MSI) e o resíduo da amostra (MSRes) dividido pela matéria seca incubada, conforme a equação: DIVMS= (MSI-MSRes) / MSI. O delineamento utilizado foi o inteiramente casualizado, e os dados analisados pelo software estatístico SAS University Edition® (SAS INSTITUTE, 2015).Resultados e Discussão
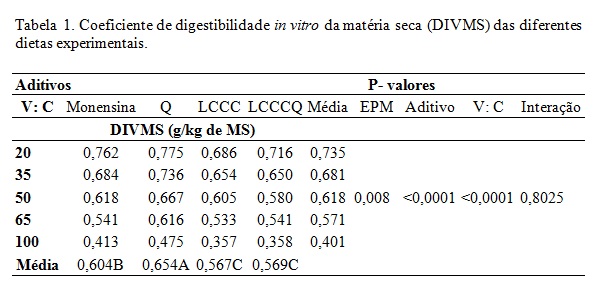
Não foi verificada interação significativa entre a relação V: C e aditivo para a digestibilidade da MS, porém, os efeitos individuais foram significativos. De acordo com a análise de regressão, observou-se efeito linear sobre a digestibilidade in vitro da e MS (P<0,001) (Tabela 1). Médias com letras diferentes dentro da mesma linha diferem entre si pelo teste de Tukey (P<0,05). Regressão relativas aos níveis de Volumoso com concentrado: ¹Ŷ=0,893552-0,00422977x(R²=0,98)(P<0,001); ²Ŷ=0,825427-0,004159x (R²=0,99) (P<0,001); ³Ŷ=0,589255+0,00647997x-0,00006240x² (R²=0,94) (P=0,00061). Jacaúna (2016) analisando a inclusão de diferentes níveis de quitosana in vitro encontrou aumento da digestibilidade da MS para todas as dietas na dose 371 mg/L, associado a redução da digestibilidade in vitro da PB. Estes dados corroboram com os dados apresentados neste trabalho. A inclusão do LCCC associado ou não com a quitosana, proporcionou redução da DIVMS. Disponibilizando maior quantidade de energia para o animal. No entanto Díaz (2013), observou até o nível de inclusão de 0,5 g/kg de MS de LCCC aumento na DIVMS, verificando uma queda acima deste valor.Conclusões
Os resultados observados neste experimento demonstraram que a quitosana e LCCC, isoladamente, adicionados a dieta de ruminantes como aditivos moduladores da fermentação ruminal favorecem o aproveitamento dos nutrientes da dieta e resulta em efeitos positivos na digestibilidade dos nutrientes, possibilitando substituir os antibióticos ionóforos. No entanto, quando trabalhado em associação reduz a digestibilidade, podendo comprometer o desempenho dos animais.Gráficos e Tabelas