CITOTOXICIDADE DE NANOPARTÍCULAS DE PRÓPOLIS EM CÉLULAS EPITELIAIS DA GLÂNDULA MAMÁRIA BOVINA DA LINHAGEM MAC-T
2 - Estudante de Pós-doutorado do Programa de Pós-graduação em Agroecossistemas- PGA/CCA-UFSC
3 - Estudante de Pós-doutorado do Programa de Biotecnologia e Biociências-UFSC
4 - Estudante de Graduação do curso de Zootecnia-CCA-UFSC
5 - Docente do Depto de Zootecnia e Desenv. Rural-CCA-UFSC
6 - Docente do Depto de Zootecnia e Desenv. Rural-CCA-UFSC
RESUMO -
Avaliou-se in vitro a citotoxicidade de nanopartículas de própolis em células epiteliais mamárias bovina da linhagem MAC-T. Suspensões de nanopartículas foram preparadas por emulsificação espontânea usando diferentes concentrações de extrato de própolis e dos tensoativos poloxamer e lecitina de soja. A viabilidade celular foi avaliada pelo método do MTT method (3-4,5-dimethylthiazol-2-yl-2,5-diphenyltetrazolyl bromide; 0,5 mg/mL). Após exposição às concentrações de 39 a 625µg/mL não foram encontradas diferenças quanto à citotoxicidade entre as nanopartículas. A única concentração que não apresentou efeito citotóxico foi a de 39 µg/mL. As demais reduziram a viabilidade celular. Os valores de concentração inibitória 50% (IC50) das formulações variaram de 122,2 a 159,1µg/mL. Concluiu-se que as nanopartículas de própolis avaliadas possuem efeito citotóxico para células MAC-T, devendo-se ter cautela na administração intramamária desse produto para o tratamento da mastite bovina.
CYTOTOXICITY OF PROPOLIS NANOPARTICLES TO BOVINE MAMMARY GLAND EPITHELIAL CELLS (MAC-T LINE)
ABSTRACT - The cytotoxicity of propolis nanoparticles to bovine mammary gland epithelial cells (MAC-T lineage) was evaluated in vitro. Suspensions of nanoparticles were prepared by spontaneous emulsification using different concentrations of propolis extract, poloxamer and soybean lecithin surfactants. Cell viability was assessed by the MTT method (3-4,5-dimethylthiazol-2-yl-2,5-diphenyltetrazolyl bromide; 0,5 mg/mL). After exposure to the concentrations of 39 to 625 μg/mL no differences were found regarding cytotoxicity between the nanoparticles. The only concentration that did not present a cytotoxic effect was 39 μg/mL. All the other concentrations reduced the cellular viability. The 50% inhibitory concentration (IC50) values of the formulations ranged from 122,2 to 159,1 μg/mL. It was concluded that the propolis nanoparticles tested are cytotoxic to MAC-T cells and the intramammary administration of this product towards bovine mastitis treatment should be performed with caution.Introdução
A própolis é uma substância resinosa produzida pelas abelhas através da colheita de diversas partes das plantas e exsudatos para vedação e assepsia de colméias. A cor, sabor, aroma e consistência da própolis podem variar conforme sua origem, época e diversidade vegetal. Considerando que a própolis é reconhecida por exercer diversas atividades biológicas, tais como antimicrobiana e anti-inflamatória, esta se constitui em um produto em potencial para o tratamento da mastite bovina. Entretanto, o potencial da própolis como agente antimicrobiano e anti-inflamatório é limitado para aplicação intramamária devido a sua baixa solubilidade em meio aquoso. Desse modo, tem sido proposta a aplicação da nanotecnologia no desenvolvimento de produtos a base de própolis. Nesse caso, sistemas aquosos de nanoencapsulamento podem proporcionar o aumento da estabilidade dos compostos ativos, o aumento do poder de penetração dos compostos de interesse bem como a diminuição da citotoxicidade. O objetivo do presente estudo foi comparar a citotoxicidade de três diferentes nanopartículas de própolis em células epiteliais mamárias bovinas da linhagem MAC-T.Revisão Bibliográfica
O aumento do uso de antimicrobianos para o controle da mastite é preocupante por poder acarretar no aumento de resíduos de antibióticos no leite e também no desenvolvimento de cepas resistentes aos diversos grupos químicos utilizados. A mastite que é caracterizada pela inflamação da glândula mamária, ocorre principalmente em decorrência da contaminação por bactérias (Bradley, 2002). Nesse cenário, cabe destacar que em amostras de leite comercializados no Paraná 19% delas estavam contaminadas por resíduos dos antibióticos cloranfenicol, tetraciclinas, gentamicinas, estreptomicinas e β-lactâmicos (Vieira et al., 2012). Busca-se, portanto, por métodos alternativos visando o controle da doença. Os produtos naturais, a exemplo da própolis, são potenciais candidatos já que podem envolver ações antimicrobiana, antioxidante, anti-inflamatória, entre outras. A própolis é uma substância resinosa produzida pelas abelhas através da colheita de diversas partes das plantas e exsudatos utilizados na construção e manutenção das suas colmeias, para vedação e assepsia. Representa um material multifuncional, com cor, sabor, aroma e consistência variados conforme sua origem, época e diversidade vegetal. Constitui-se uma matéria-prima importante base para muitos produtos de saúde que constituem uma nova área interdisciplinar de pesquisa (dos Santos et al., 2002). Apesar de já ser utilizada empiricamente, alguns estudos recentes estão sendo realizados in vitro para investigar o potencial da própolis no controle da mastite bovina (Fiordalisi et al., 2016; Saeki et al., 2011; Pinto et al., 2001; Silva et al., 2012). Mesmo conhecendo o potencial biológico da própolis no tratamento da mastite bovina, ressalta-se que sua hidrofobicidade requer a utilização de solventes orgânicos, e.g. etanol, para sua solubilização, limitando o seu uso intramamário. Logo, associar a própolis à nanotecnologia pode ser uma alternativa para o tratamento da mastite bovina através do desenvolvimento de sistemas aquosos nanoestruturados, visando melhorar a solubilidade, a efetividade e a toxicidade. A nanotecnologia pode ser vista como uma alternativa promissora para a saúde animal, para a medicina veterinária e para outras áreas de produção animal, pois benefícios significativos para a sociedade poderiam surgir da sua aplicação (Kuzma, 2010).Materiais e Métodos
O extrato hidroalcoólico da própolis de Urupema (SC) foi preparado a partir da maceração em etanol 70% (1:10, m/v) e utilizados para preparar três diferentes nanopartículas de própolis pela técnica de emulsificação espontânea. As nanopartículas diferiram quanto às concentrações de própolis e tensoativos: N1 7% de própolis, 4% de poloxamer e 1% de lecitina; N2 5% de própolis, 1% de poloxamer e 0,25% de lecitina; N3 5% de própolis, 3% de poloxamer e 0,7% de lecitina. As células epiteliais mamárias bovina (MAC-T) foram cultivadas em meio DMEM (Dulbecco’s Modified Eagle’s Medium) e suplementadas. As células foram mantidas à 37°C em atmosfera úmida a 5% de CO2. Quando com 70% de confluência foram tratadas com 0,25% de tripsina com 1mM EDTA e contadas em câmera de Neubauer. Foram plaqueadas e incubadas 10.000 células por poço. O efeito das nanopartículas sobre a viabilidade celular foi avaliado pelo método do MTT que quantifica quanto do MTT presente no meio é reduzido (Mosmann, 1983). Ao meio de cultura contendo as células aderentes, foram acrescidas diferentes concentrações das nanopartículas, variando de 39 a 625 µg/mL e após 24 h, o MTT (brometo de 3-4,5-dimetiltiazol-2-il-2,5-difeniltetrazolil; 0,5 mg/mL) foi adicionado. A quantidade de formazan formado foi medida à 546 nm e considerada diretamente proporcional ao número de células viáveis. Três formulações sem a própolis foram testadas, nas mesmas concentrações, e consideradas como controle negativo. As análises estatísticas foram realizadas através da análise de variância (ANOVA), seguida pelo teste post-hoc de Tukey, usando o software Graph-Pad Prism (GraphPad Software Inc., San Diego, CA, USA). Valores de P < 0,05 foram considerados significativos. Os dados foram expressos como média ± desvio padrão (SD). Os experimentos foram realizados em triplicata. Determinou-se também a IC50, concentração responsável pela redução da metade da viabilidade celular, através de uma estatística de regressão linear.Resultados e Discussão
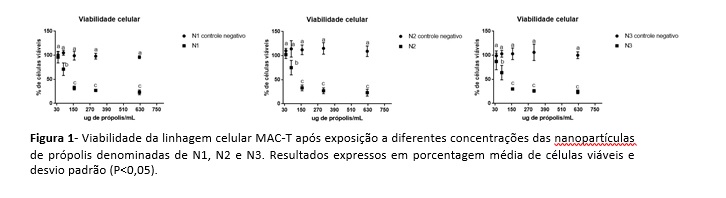
O efeito das nanopartículas N1, N2 e N3 sobre a viabilidade das células MAC-T está mostrado na Figura 1, podendo-se verificar que o efeito foi similar quando se compara as mesmas concentrações das diferentes nanopartículas (P<0,05). Tais resultados, devem-se provavelmente a similaridade da eficiência de encapsulação dos compostos ativos e aos tamanhos médios de partículas obtidos para cada formulação. Em relação às concentrações testadas, verificou-se que a única concentração que não apresentou efeito citotóxico foi 39 µg/mL. A partir de 78 μg/mL, as demais concentrações mostraram-se citotóxicas quando comparadas ao controle, i.e., meio fresco (Figura 1). É importante também ressaltar que o controle negativo de cada nanopartícula estimulou a proliferação celular em todas as concentrações testadas (Figura 1). Resultados semelhantes estão descritos na literatura sobre a citotoxicidade de extratos de própolis. O extrato etanólico de própolis nas concentrações de 500 a 2000 μg/mL também apresentaram efeito citotóxico e genotóxico, in vitro, para linfócitos humanos periféricos (Montoro et al., 2012). Da mesma forma, Campos et al. (2014), encontraram efeito citotóxico do extrato etanólico de própolis produzida no Mato Grosso do Sul em células K562. Neste trabalho, verificou-se uma correlação entre a concentração do extrato e a citotoxicidade, o que não foi demonstrado no presente estudo. O cálculo de IC50, no presente estudo, mostrou que as nanopartículas N1, N2 e N3 reduziram em 50% a viabilidade das células MAC-T, em concentrações próximas de 150 μg/mL. Os valores de IC50 para as formulações N1, N2 e N3 foram 159,1±3,70; 145,3±4,47 e 122,2±6,87 µg/mL, respectivamente. Similarmente Fiordalisi et al. (2016), ao avaliarem a citotoxicidade da própolis do município de Urupema (SC) sobre explantes mamários bovinos, relataram redução de cerca de 50% do número de células viáveis a partir de 140 μg/mL. Já Mouse et al. (2012), encontraram efeito citotóxico dos extratos de própolis marroquina sobre células tumorais em concentrações bem inferiores. Neste caso, os valores de IC50 variaram de 15 a 38 μg/mL. Frozza et al. (2013), ao avaliarem também os efeitos citotóxicos da própolis vermelha do nordeste brasileiro, encontraram valores de IC50 de 64 μg/mL em células tumorais e maiores que 150 μg/mL em células humanas normais. De maneira geral, esses estudos atribuem aos diferentes componentes químicos da própolis os efeitos observados, os quais devem ter ação sinérgica, evidenciando a importância de se conhecer a sua origem, época de coleta e a diversidade vegetal do local (Fiordalisi et al., 2016; Zizic et al., 2013; Thirugnanasampandan et al.,2012; Mouse et al., 2012). A própolis é amplamente utilizada na medicina tradicional e pode contribuir com o desenvolvimento de novos fármacos na medicina veterinária, desde que seus efeitos toxicológicos sejam conhecidos para validar sua aplicabilidade.Conclusões
O estudo de citotoxicidade in vitro demonstrou que as suspensões de nanopartículas afetaram a viabilidade celular de linhagem de células de glândula mamária bovina MAC-T de forma dependente da concentração. As nanopartículas de própolis N1, N2 e N3 apresentaram efeito citotóxico similar frente às células da linhagem MAC-T cultivadas in vitro. Para as três formulações, evidenciou-se efeito citotóxico a partir de 78 μg/mL. Sugere-se a associação dos resultados obtidos nos ensaios de viabilidade celular com ensaios antimicrobianos para uma possível indicação de uso intramamário para o controle da mastite bovina.Gráficos e Tabelas