Efeito da aplicação de Fipronil e seus metabólitos em solo natural sobre a reprodução de Folsomia candida
2 - UTFPR
3 - UDESC
4 - UDESC
5 - UDESC
6 - UDESC
7 - Universidade de Coimbra
RESUMO -
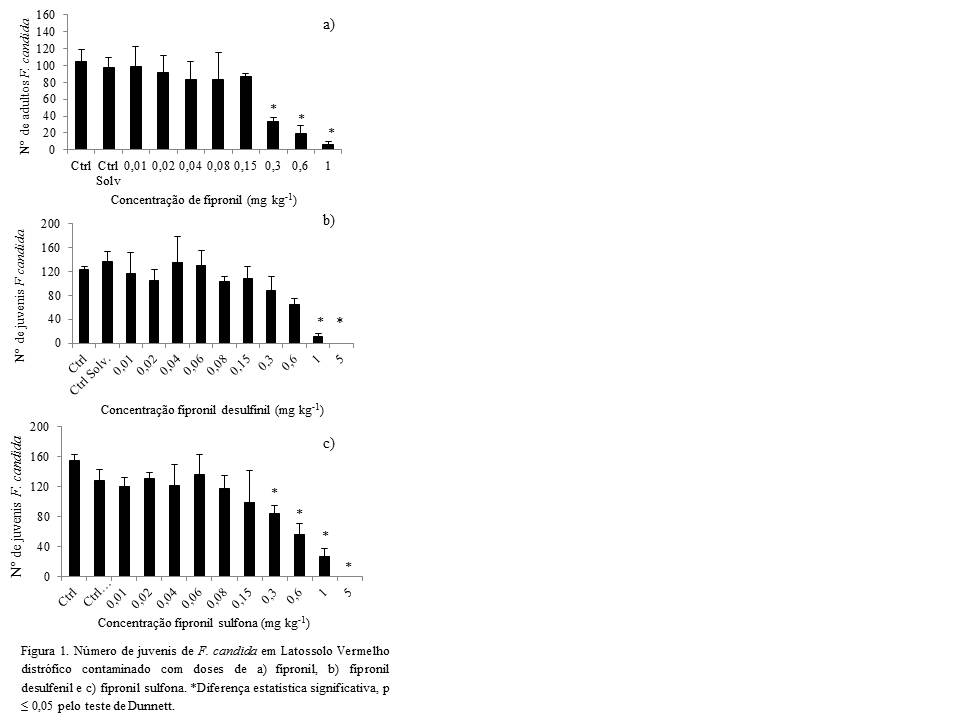
A principal forma de entrada no ambiente terrestre de fármacos da pecuária intensiva é através dos dejetos. O fipronil é altamente tóxico e poucas são as informações que determinam qual o nível de toxicidade para organismos do solo. O presente estudo tem como objetivo avaliar a toxicidade do fármaco veterinário fipronil e seus metabólitos fipronil sulfona e fipronil desulfinil sobre a reprodução de colêmbolos Folsomia candida por meio de ensaios ecotoxicológicos determinados pelas diretrizes da ISO. Para o estudo foi utilizado Latossolo e as doses testadas para fipronil foram 0; 0,02; 0,04; 0,08, 0,15; 0,30; 0,60 e 1 mg kg-1 do ingrediente ativo. Já para os metabólitos fipronil sulfona e fipronil desulfinil as doses testadas foram: 0; 0,01; 0,02; 0,04; 0,06; 0,08; 0,15; 0,30; 0,60, 1 e 5 mg kg-1 do metabólito. A presença do fipronil e seus metabólitos fipronil sulfona e fipronil desulfinil afetam significativamente a reprodução de colêmbolos Folsomia cândida.
Effect of the application of Fipronil and its metabolites in natural soil on the reproduction of Folsomia candida
ABSTRACT - The main form of entry into the terrestrial environment of intensive livestock drugs is through waste. The fipronil is highly toxic and there is little information that determines the level of toxicity to soil organisms. The present study aims to evaluate the toxicity of the veterinary drug fipronil and its metabolites fipronil sulfone and fipronil desulfinil on the reproduction of Folsomia candida by means of ecotoxicological tests determined by the ISO guidelines. For the study was used Oxisol and doses tested for fipronil were 0; 0.02; 0.04; 0.08, 0.15; 0.30; 0.60 and 1 mg kg-1 of the active ingredient. For the metabolites fipronil sulfone and fipronil desulfinil, the doses tested were: 0; 0.01; 0.02; 0.04; 0.06; 0,08; 0,15; 0.30; 0.60, 1 and 5 mg kg-1 of the metabolite. The presence of fipronil and its metabolites fipronil sulfone and fipronil desulfinil significantly affect the reproduction of Folsomia candida.Introdução
O fipronil é um fenilpirazol de amplo espectro recomendado para uso agrícola e uso veterinário, sendo eficaz principalmente no controle de carrapatos (CID et al., 2016). No entanto, o fipronil é altamente tóxico e poucas são as informações que determinam qual o nível de toxicidade para organismos não-alvo do solo. Além do produto original o fipronil pode sofrer transformações metabólicas e degradações abióticas em vários produtos (SAN MIGUEL et al., 2008). A espécie de colêmbolos Folsomia candida é recomendada para ensaios em protocolos ISO (1999), sendo a mais representativa para avaliar a qualidade do solo, além disso é considerada um excelente bioindicador em ensaios ecotoxicológicos (BUCH et al., 2016). Portanto, o estudo da resposta de colêmbolos em solos contaminados é de grande interesse, principalmente em relação aos fármacos veterinários, os quais são considerados contaminantes emergentes em locais de grande produção pecuária (DI NICA et al., 2015). O presente estudo tem como objetivo avaliar a toxicidade do fármaco veterinário fipronil e seus metabólitos fipronil sulfona e fipronil desulfinil sobre a reprodução de colêmbolos da espécie Folsomia candida por meio de ensaios ecotoxicológicos determinados pelas diretrizes da ISO.Revisão Bibliográfica
O carrapato (Rhipicephalus microplus) é considerado um grande vilão na pecuária brasileira. Quando em condições de infestações nos animais, os carrapatos são capazes de causar prejuízos na produtividade, em virtude do estresse, perda de peso, danos ao couro, além de gastos relacionados ao controle químico deste parasito (SILVA et al., 2010). O uso inadequado de carrapaticidas em conjunto com a falta de orientação técnica de como controlar os carrapatos vem se tornando um grande problema na produção animal, pois estes fatores contribuem para a formação de cepas resistentes (PAZINATO et al., 2014). Há uma crescente preocupação sobre os potenciais impactos dos medicamentos de uso veterinário no ambiente e taxa de excreção da substância depende do fármaco, da dosagem, bem como, do organismo ao qual é administrada (MELO et al., 2009). A presença medicamentos veterinários nos dejetos é capaz de afetar os organismos não alvos, que são responsáveis, juntamente com o intemperismo, na decomposição do esterco nas pastagens e ciclagem de nutrientes, de forma que apresentam ação funcional e economicamente importante no sistema (LUMARET et al., 2012). Assim, é necessário buscar alternativas para mensurar qual o nível de impacto que esses produtos causam no solo, sendo a ecotoxicologia terrestre uma ferramenta que possibilita avaliar os efeitos que os fármacos veterinários causam no ambiente solo (OLIVEIRAFILHO e BARETTA, 2016). De acordo com as diretrizes atuais sobre avaliação de risco ambiental na União Europeia, o risco dos medicamentos veterinários para os organismos do solo tem que ser avaliado através de dados experimentais sobre o destino e os efeitos do fármaco. Todavia, a fim de garantir a qualidade dos dados e visando permitir a comparabilidade dos resultados, testes devem ser realizados de acordo com a padronização internacional das diretrizes (HOKE et al., 2016). O conhecimento ecotoxicológico permite avaliar a extensão do risco ambiental, estipular metodologias de vigilância e rastreamento da presença de tóxicos no ambiente e ainda orientar em medidas de remediação (AZEVEDO e CHASIN, 2004).Materiais e Métodos
Para o estudo foram utilizadas amostras do Latossolo Vermelho distrófico coletado em uma área de mata sem histórico de aplicação de pesticida ou atividade pecuária. Os tratamentos consistiam em doses crescentes de um medicamento veterinário com ingrediente ativo a base de fipronil (TopLine RED®), e dois de seus principais metabólitos o fipronil sulfona e fipronil desulfinil. As doses testadas para fipronil foram 0; 0,02; 0,04; 0,08, 0,15; 0,30; 0,60 e 1 mg kg-1 do ingrediente ativo. Já para os metabólitos fipronil sulfona e fipronil desulfinil as doses testadas foram: 0; 0,01; 0,02; 0,04; 0,06; 0,08; 0,15; 0,30; 0,60, 1 e 5 mg kg-1 do metabólito. Para cada solo foi realizado um tratamento controle solvente (solo cravado apenas com acetona), a fim de garantir que não haveria efeitos do solvente sobre o desempenho reprodutivo dos organismos de teste. Os efeitos de toxicidade sobre F. candida foram avaliados através de testes de reprodução, baseados nos métodos descritos pela ISO 11267 (ISO, 1999), com seis réplicas para os testes com fipronil e oito para os testes com os metabólitos. Cada unidade experimental consistia em um pote cilíndrico com 30g de solo e sua respectiva concentração, onde eram colocados 10 indivíduos sincronizados e cada teste teve duração de 28 dias. No decorrer do período experimental os potes eram abertos semanalmente para a correção da umidade do solo, além disso, os organismos foram alimentados no dia 0 e 14 do ensaio, com fermento biológico (Saccharomyces cerevisiae). Ao final do teste o conteúdo do solo foi despejado em um recipiente maior e adicionado água com algumas gotas de tinta preta e uma leve agitação, o que possibilitou a flutuação dos organismos. As imagens de cada recipiente foram analisadas pelo software Image Tool 3.0 para quantificação dos organismos. Os dados de reprodução dos colêmbolos foram submetidos a análise de variância (ANOVA One-Way), seguida pelo teste de Dunnett (p<0,05), utilizando o software Statistica 7.0.Resultados e Discussão
Todos os testes cumpriram os critérios de validação de acordo com a norma da ISO 11267 (1999). Nos testes de reprodução o número de juvenis nos controles foi acima de 100 indivíduos (média > de 120 indivíduos) com coeficiente de variação inferior a 30%. Os resultados de reprodução com fipronil desulfinil (Figura1. b) e fipronil sulfona (Figura1. c), foram muito semelhantes ao próprio fipronil (Figura1. a). Onde nas doses mais baixas não houve redução significativa (p>0,05), enquanto nas maiores doses, principalmente acima de 0,60 mg kg-1 a redução foi superior a 50% na reprodução, e na dose de 5 mg kg-1 não foi encontrado nenhum individuo vivo, para ambos os metabólitos. A redução da reprodução dos colêmbolos, pode ser atribuída pelo seu mecanismo de ação do fipronil, que causa o bloqueio do neurotransmissor ácido aminobutírico (GABA) (ISLAM e LYNCH, 2012), ocasionando hiperexitação e morte dos insetos (ZHAO et al., 2004). Contudo, descobriu-se que a seletividade do fipronil em invertebrados não se limita apenas aos receptores de GABA, mas que ele inibe potencialmente os canais de glutamato-cloro (GluCl), que estão presentes em invertebrados, sendo muito mais tóxicos para os insetos (HOVDA e HOSER , 2002). A toxicidade de compostos químico está relacionada a fatores, como, a classe textural do solo (teores de argila), conteúdo de matéria orgânica (FILSER et al., 2014) e pelo equilíbrio dinâmico entre a fases sólida e líquida do solo nos ambientes terrestres (SMIT e VAN GESTEL, 1998). Todos esses fatores juntos determinam os processos de adsorção dos contamines e consequentemente os efeitos ecotoxicológicos de forma diferenciada (DOMENE et al., 2010). Ravanel et al. (1999) inferiram que ligação de pesticidas lipofílicos, incluindo fipronil, possui difusão lenta dentro e fora da rede de microagregados, típica de Latossolos, onde as partículas orgânicas e minerais estão intimamente associadas, o que indica que os complexos organo-minerais são adsorventes para fipronil e as superfícies minerais contribuíram para a adsorção do fipronil em maior quantidade, pela presença de grandes quantidades de oxihidróxidos de ferro (MASSUTI e MERMUT, 2007).Conclusões
A presença do fármaco veterinário fipronil e seus metabólitos fipronil sulfona e fipronil desulfinil afetam significativamente a reprodução de colêmbolos Folsomia candida. Além disso, é necessário desenvolver estudos que determinem a excreção do fármaco fipronil quando aplicado nos animais, uma vez que esse tipo de informação é inexistente e de extrema importância para desenvolvimento de estudos ecotoxicológicos.Gráficos e Tabelas