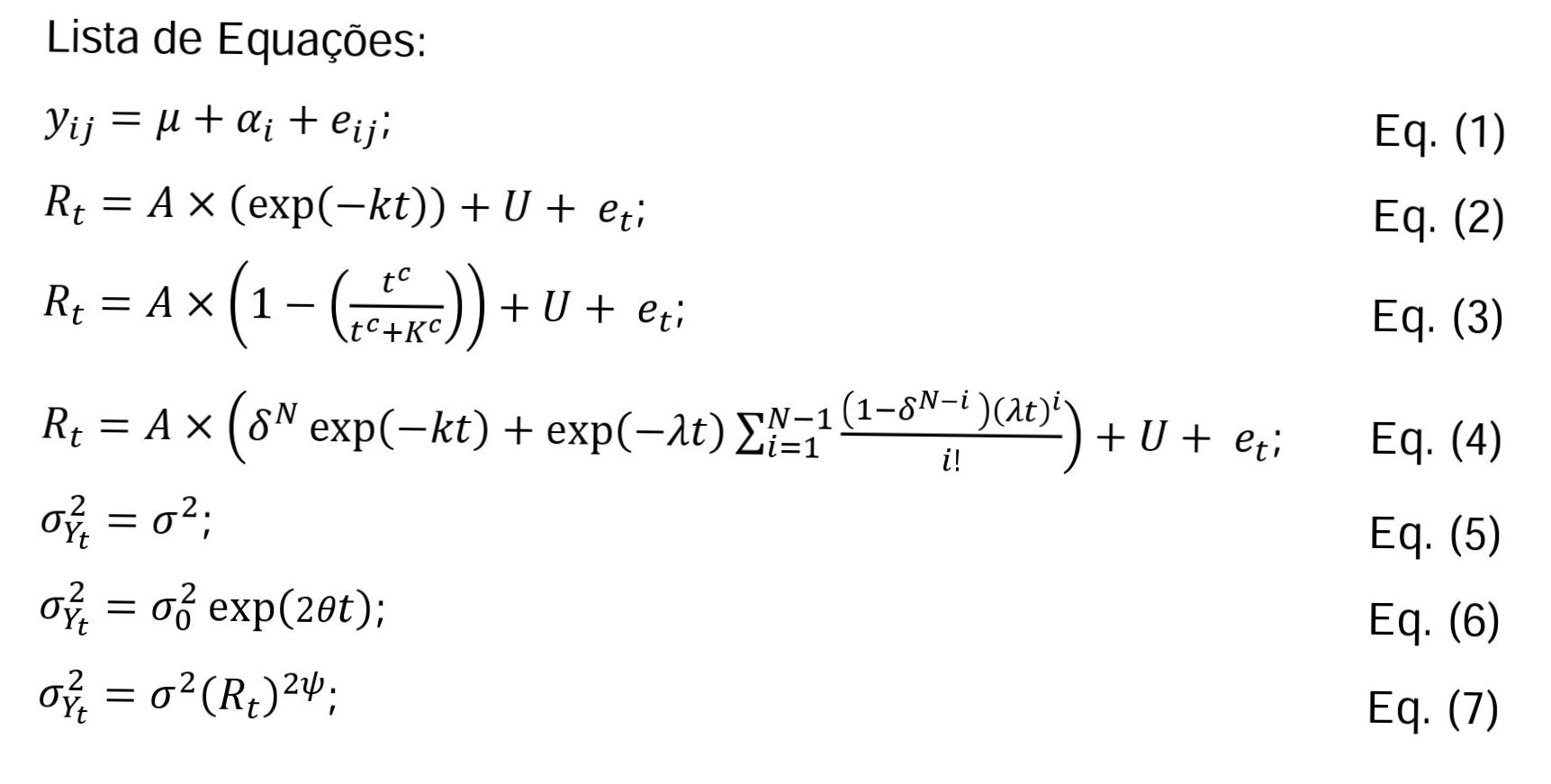Estimativa de parâmetros cinéticos de degradação in vitro de plantas forrageiras
2 - UENF
3 - UENF
4 - UENF
5 - UENF
6 - UENF
7 - UENF
8 - UENF
RESUMO -
O objetivo deste estudo foi estimar os parâmetros cinéticos de degradação de alguns recursos forrageiros comumente utilizados na alimentação de ruminantes. Amostras de 18 plantas forrageiras foram incubadas em banho-maria a 39°C. Foram utilizados frascos de vidro de 100 mL, 0,5 g de amostra, 40 mL de meio de cultura e 10 mL de inoculo ruminal, nos tempos 0, 1, 3, 6, 9, 12, 24, 36, 72, 96. O modelo que apresentou o melhor ajuste aos perfis de degradação de todas as plantas forrageiras foi o GNG1. A fração indigestível estimada para as fabáceas foi em média 1,7 vezes maior do que nas poáceas. Os carboidratos fibrosos das fabáceas são digeridos em menor extensão se comparados às poáceas, no entanto as taxas de degradação não apresentaram diferença. Fabáceas apresentam maior fração indigestível que as poáceas.
Estimation of kinetic parameters of in vitro degradation of forage plants
ABSTRACT - The objective of this study was to estimate the kinetic parameters of degradation of some forage resources. Samples from 8 fodder plants were incubated in a water bath at 39 ° C, 100 mL glass vials, 0.5 g sample, 40 mL culture medium and 10 mL ruminal inoculum were used at times 0, 1, 3, 6, 9, 12, 24, 36, 72, 96 Hours. The model that presented the best fit was GNG1. The estimated indigestible fraction for the fabaceae was on average 1.7 times higher than in the poaceae. The fibrous carbohydrates of the fabaceae are digested to a lesser extent when compared to the poaceae, however the degradation rates did not show any difference. Fabaceae have a larger indigestible fraction than the poaceae.Introdução
Os métodos de análises in vitro são comumente utilizados para estimar a degradabilidade da matéria orgânica dos alimentos oferecidos para ruminantes por meio da quantificação do desaparecimento do substrato durante a incubação (Tilley e Terry, 1963; Goering e Van Soest, 1970). A descrição matemática dos perfis de degradação permite a análise de informações e a comparação entre substratos ou características de fermentação, e pode prover informações úteis referentes à composição dos substratos e a degradabilidade dos componentes de baixa solubilidade (Groot et al., 1996). A maior dificuldade para a quantificação da cinética de degradação da fibra consiste na correta definição da fração indigerível dos alimentos estudados (Mertens, 2005). Os modelos existentes são capazes de imitar os perfis de degradação e apenas por meio de incubações de longo prazo é possível estimar adequadamente os parâmetros cinéticos (Vieira et al., 2008; Vieira et al., 2012). A estimação da fração indigestível é a tarefa mais importante para que se possa obter estimativas mais acuradas do valor nutricional dos alimentos (Van Soest et al., 2005; Vieira et al., 2012). Objetivou-se estimar os parâmetros cinéticos de relevância biológica com base em perfis de degradação gravimétrica in vitro de diversas plantas forrageiras comumente utilizadas na alimentação de ruminantes.Revisão Bibliográfica
Existem vários métodos para a determinação da digestibilidade de alimentos para ruminantes. O método in vivo, por ser realizado em ensaios de digestão com animais, é o procedimento de referência e aquele que, preferencialmente, deve ser utilizado para calibração das demais técnicas. No entanto, o método in vivo é oneroso, laborioso e demorado, além de não permitir avaliação simultânea de vários alimentos (Lopes et al., 2010). Métodos in vivo são considerados os mais confiáveis, porém apresentam desvantagens como: requerimento de grandes quantidades de alimentos, número alto de repetições e elevado custo. Os métodos in vitro que utilizam fermentação microbiana ruminal em substituição aos métodos in situ para avaliar a digestibilidade dos alimentos têm sido usados por décadas (Tilley e Terry, 1963; Goering e Van Soest, 1970). As técnicas in vitro são consideradas mais baratas do que as técnicas in vivo e in situ, e oferecem a possibilidade de avaliar tanto o resíduo quanto os metabólitos da degradação microbiana. Métodos in vitro podem, em última análise, permitir o controle de vários fatores que alteram a degradação do alimento (população microbiana, animais, ambiente) e, por conseguinte, permitir a uniformidade na caracterização da degradação dos alimentos (Mohamed e Chaudhry, 2008). Resultados de ensaios empíricos podem ser correlacionados com a digestibilidade dos alimentos em animais (Tilley e Terry, 1963) e serem utilizados para prever o desempenho animal. Os valores de digestibilidade in vitro da fibra em detergente neutro (FDN) têm sido utilizados em programas de avaliação, em formulações de dietas ou para descrever o potencial de contribuição de nutrientes digestíveis de um determinado ingrediente na dieta (Hall e Mertens, 2008). Os diferentes métodos de estimativa da degradação afetam os parâmetros da degradação, principalmente a taxa de degradação e o tempo de latência (Grant e Mertens, 1992). Hall e Mertens (2008) avaliaram diferentes metodologias para estimação da digestibilidade gravimétrica da fibra e concluíram que os parâmetros da degradação podem ser alterados pela metodologia de fermentação adotada; consequentemente, os valores de degradação da fibra observados para os diferentes métodos não são comparáveis. A confiabilidade nas estimativas da cinética de degradação é dependente de diversos fatores, entre eles: a diluição do fluido ruminal, manuseio do fluido ruminal, manutenção das condições do rúmen, tipo de tamponante, tamanho da partícula, dieta do animal doador e tempo de fermentação (Stern et al., 1997). No método in vitro, as amostras são acondicionadas em tubos ou frascos, com solução tampão, o meio de cultura e o inóculo ruminal, as amostras passam por vários regimes de gaseificação dependendo da marcha utilizada. O método de análise de fermentação in vitro (Tilley e Terry, 1963; Goering e Van Soest, 1970) é amplamente utilizado porém apresenta desvantagens, tais como: 1) a análise da fibra destrói a amostra e são necessárias diferentes amostras para cada ponto de avaliação, de forma que estes estudos de cinética são trabalhosos, caros e com poucas repetições em cada tempo de incubação; 2) os estágios iniciais da digestão são de difícil estudo devido a perda de massa ser baixa; 3) a taxa de degradação dos componentes solúveis da forragem não é determinada.Materiais e Métodos
O trabalho foi realizado no Laboratório de Zootecnia da Universidade Estadual do Norte Fluminense Darcy Ribeiro. Amostras das fabáceas: galactia (Galactia striata (Jacq.) Urb.), macrotiloma (Macrotyloma axillare (E. Mey.) Verdc.), desmódio (Desmodium heterocarpon (L.) DC. subsp. ovalifolium (Prain) H. Ohashi), amendoim forrageiro cv. Belmonte (Arachis pintoi Krapov. & W.C. Greg.), kudzu (Pueraria phaseoloides (Roxb.) Benth.), cunhã (Clitoria ternatea L.), alfafa (Medicago sativa L.) e sábia (Mimosa caesalpiniaefolia Benth.) e das poáceas: milho (Zea mays L.),capim-elefante cv. Cameroon (Pennisetum purpureum Schum.), tifton-85 (Cynodon nlemfuensis Vanderyst x Cynodon dactylon (L.) Pers.), coast-cross (Cynodon dactylon (L.) Pers.), braquiária brizanta cv. MG-5 (Urochloa brizantha (Hochst. ex A. Rich.) R. Webster), andropogon cv. Bisquamulatus (Andropogon gayanus Kunth), capim Massai (Urochloa maxima (Jacq.) R. Webster), capim suazi (Digitaria swazilandensis Stent.) e azevém (Lolium perenne L.) foram obtidas para realização de estudos de cinética de degradação de carboidratos por meio de técnicas de incubação in vitro. As amostras de galactia, macrotiloma, desmódio, amendoim forrageiro, kudzu, coast-cross, andropogon, capim suazi, capim massai e braquiária foram cultivadas durante o verão no município de Seropédica-RJ, clima do tipo AW. As poáceas foram colhidas aos 28 dias e as fabáceas foram colhidas aos 60 dias, exceto o desmódio que foi colhido aos 90 dias. As amostras de cunhã, sábia, capim-elefante e milho foram cultivadas durante o verão no município de Campos dos Goytacazes-RJ, clima do tipo AW. A cunhã foi colhida aos 60 dias, o sábia foi colhido aos 70 dias e apenas as folhas e a parte apical dos ramos foram utilizados. O capim-elefante foi colhido quando atingiu 1,70 m de altura. O milho foi colhido no ponto de silagem e ensilado por pelo menos 60 dias. Desta mesma lavoura de milho, aproveitou-se as espigas não colhidas pela ensiladeira e confeccionou-se uma silagem de espiga de milho, utilizando tambores plásticos de 200 l. As amostras de tifton 85, azevém e alfafa foram obtidas na forma de feno comercial. As amostras frescas foram secas a 55 °C durante 72 horas em estufa com ventilação forçada e moídas em moinho de facas a 1 mm. As amostras de forragem foram analisadas para matéria seca total (MS), proteína bruta (PB), gordura bruta (GB), cinzas, lignina (LDA) segundo a AOAC (1990). A matéria orgânica fibrosa (aFDNmo) foi analisada de acordo com o método AOAC 2002.04 (Mertens, 2002) por meio de adição de sulfito de sódio e de solução padronizada de amilase termoestável, e com exclusão das cinzas. Os teores de MS, GB, cinzas, PB, aFDNmo, LDA e a relação LDA:aFDNmo foram analisadas segundo o modelo inteiramente casualizado: Equação 1. No qual yij corresponde à j-ésima determinação (j = 1, 2, 3 e/ou 4) do componente químico obtido para a i-ésima espécie forrageira (i=1, 2, ..., 18). O modelo foi ajustado pelo procedimento MIXED do software SAS (v. 9, SAS Institute Inc., Cary, NC, USA) e foi utilizada a transformação de Box-Cox (Box e Cox, 1964). As incubações para a degradabilidade in vitro foram realizadas em banho-maria a 39ºC. Foram utilizados frascos de penicilina de 100 mL na cor âmbar, 0,5 g de amostra incubada com 40 mL de meio de cultura reduzido e 10 mL de inóculo ruminal (GOERING e VAN SOEST, 1970; HALL e MERTENS, 2008). O inóculo ruminal foi obtido de seis ovinos machos castrados adultos com fístula ruminal, alimentados uma vez ao dia com silagem de milho e farelo de soja em quantidade suficiente para atender 1,3 vezes as exigências de mantença. O uso de animais fistulados foi aprovado pelo Comitê de Ética e Uso de Animais/ UENF sob o protocolo n°207, intitulado Manutenção e cuidados de animais com cânulas ruminais permanentes. Foram coletadas amostras separadas dos conteúdos líquido e sólido do rúmen, duas horas após o fornecimento do alimento aos animais, armazenadas em garrafas térmicas individuais e encaminhadas para o laboratório. As amostras do conteúdo do rúmen foram batidas em liquidificador por 60 segundos na proporção de 1:2 (conteúdo sólido: líquido ruminal) com o intuito de ocasionar desprendimento das bactérias aderidas a partícula sólida do alimento, obtendo-se assim, uma amostra mais representativa da população microbiana do rúmen. Logo após, a mistura foi filtrada através de oito camadas de gazes. Em seguida, o inóculo ruminal obtido foi adicionado ao meio de cultura, previamente reduzido na proporção 4:1, mantendo a mistura a 39ºC sob infusão de CO2 constante até sua transferência para os frascos, que foram imediatamente vedados e mantidos em banho-maria a 39°C (Hall e Mertens, 2008). Foram utilizados dois banhos-maria, em cada um destes foram incubadas duas repetições de cada alimento com o inóculo ruminal tendo origem em um grupo de três animais, o conjunto formado pelo banho-maria e os três animais doadores foi considerado uma corrida. Os tempos de incubação avaliados foram 0, 1, 3, 6, 9, 12, 24, 36, 72 e 96 horas. Para cada tempo de incubação foram realizadas duas corridas, com duplicata dentro de cada corrida, totalizando 4 repetições por tempo. Além disso foi adicionado em cada banho maria dois frascos contendo apenas o inóculo ruminal e o meio de cultura (branco). Ao final de cada tempo de incubação foi realizada a análise de aFDNmo sem adição de sulfito de sódio. Aos perfis de degradação foram ajustados os seguinte modelos: Equação 2. Equação 3. Equação 4. As equações 2, 3 e 4 representam os modelos exponencial, generalizado de Michaelis-Mentem (GMM) e compartimental generalizado (GNG1), respectivamente (López et al., 1999; VIEIRA et al., 2008). Onde A é a fração potencialmente degradável. Nas equações de 2 e 4: k é a taxa de degradação das frações potencialmente degradável, Na equação 3, c é parâmetro de escala e K (h) representa o tempo gasto até o consumo de metade do substrato (meia-vida). Na equação 4, N é um número inteiro positivo que representa a ordem de dependência do tempo, l (1/h) é a assíntota da taxa de preparação para a digestão, δ = λ/(λ-k) é uma constante, U é a fração indigestível e et é o erro aleatório. Os modelos foram ajustados aos perfis de degradação por meio do procedimento NLMIXED do programa SAS (SAS System Inc., Cary, NC, USA). O melhor ajuste do modelo ao perfil foi avaliado por meio do cômputo dos critérios de informação de Akaike corrigido e suas medidas derivadas (Akaike, 1974). A suposição convencional da homocedasticidade foi avaliada usando o pacote NLMIXED do SAS (SAS Systems, Inc., Cary, NC, USA) A variância foi modelada da seguinte forma (Pinheiro e Bates, 2000): Equação 5. Equação 6. Equação 7. Onde σ2 é a variância residual homogênea como mostrado pela equação (5). A variância exponencial (equação 6) contém a variância residual inicial associada com o resíduo no tempo inicial (t=0), que aumenta exponencialmente ao longo do tempo a θ (1/hora). A equação 7 representa a variância residual escalonada pela potência (ψ) em função da média esperada, Rt.Resultados e Discussão
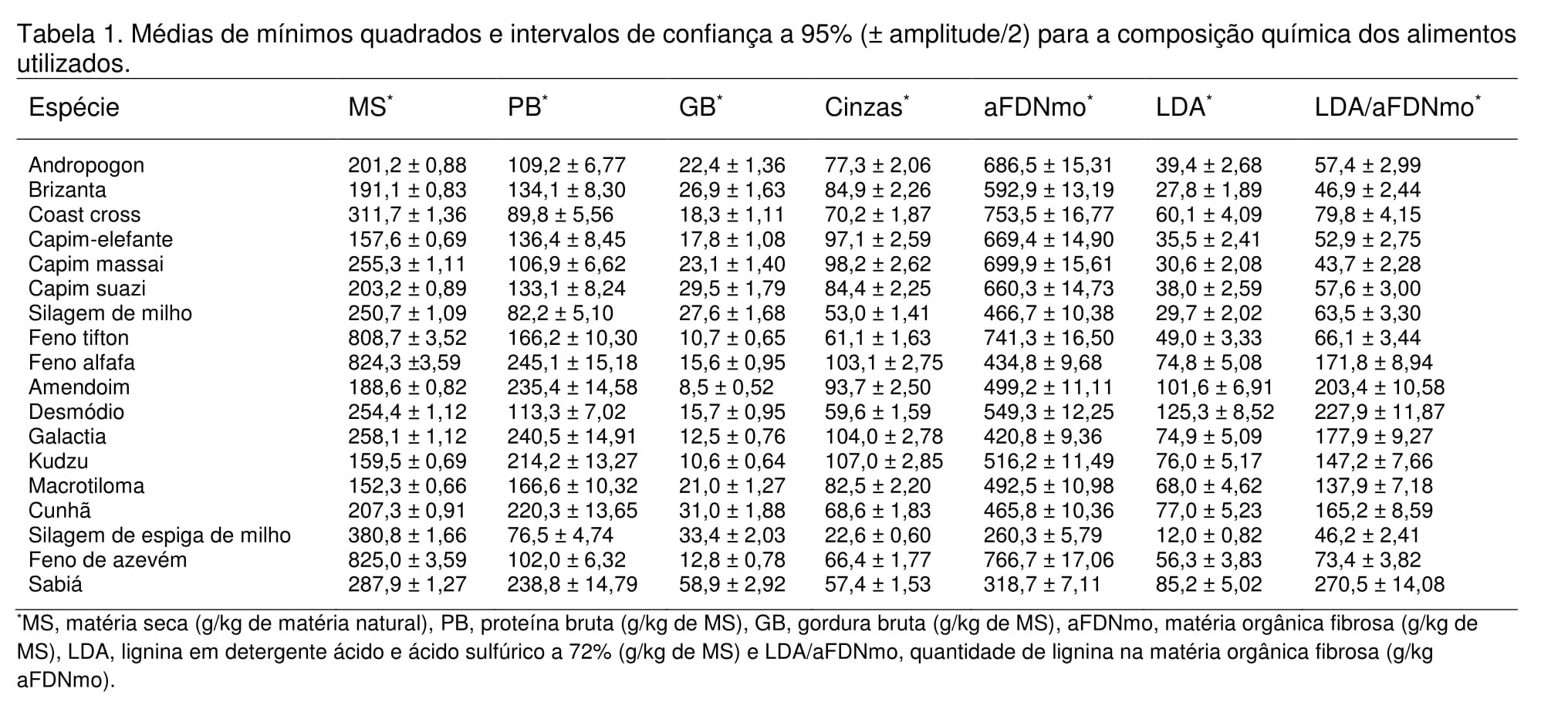
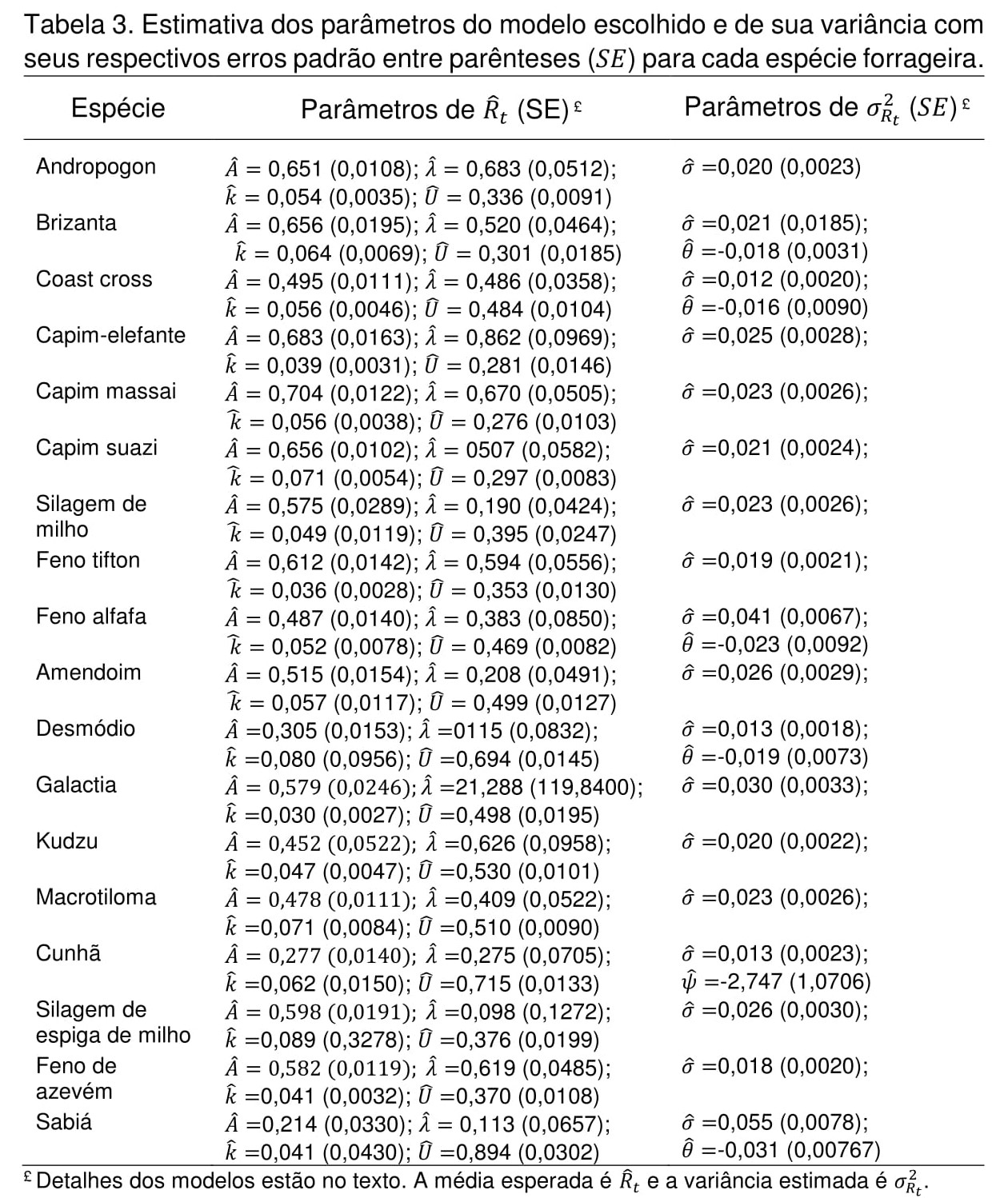
Os resultados das determinações da composição química das forrageiras utilizadas na análise cinética in vitro foram primeiramente submetidos ao ajuste do modelo descrito pela Eq. (1) para permitir estimar por ponto e por intervalo os nutrientes MS, PB, Cinzas, GB, aFDNmo, LDA e a relação LDA/aFDNmo (Tabela 1). O valor de lambda que maximizou a função de verossimilhança da transformação Box-Cox foi igual a zero para todas as variáveis referentes à composição química, inclusive para a relação LDA/aFDNmo. O modelo que permitiu a melhor interpretação quantitativa dos dados da composição química foi o de variância homogênea, o que resultou em apenas um erro padrão para as médias de todos os nutrientes (Tabela 1). As fabáceas, com base nas médias da composição predita, apresentaram 3,2 vezes mais lignina do que as poáceas para a mesma quantidade de fibra. Yoder et al. (2014) afirmaram que alguns nutrientes, como as cinzas, podem não apresentar distribuição normal, o que é corroborado pelos resultados deste estudo em que todos os nutrientes avaliados, incluindo a relação LDA/aFDNmo, apresentaram distribuição log-normal, dado o valor de lambda da transformação Box-Cox igual a zero (Box e Cox, 1964). Os ajustes dos modelos aos dados permitiram o estabelecimento de inferências seguras. Em todas as forrageiras o modelo que apresentou o melhor ajuste foi o GNG1 descrito pela Eq. (4), com N (ordem de dependência do tempo) variando de 2 a 6 (Tabelas 2), combinado com as estruturas de variância (Eq. 5-7). A fração indigestível estimada para as fabáceas foi em média 1,7 vezes maior do que nas poáceas (Tabela 3 e Figura 1). Os carboidratos fibrosos das fabáceas são digeridos em menor extensão se comparados às poáceas (Dehority e Johnson, 1961), o que pode ser corroborado pelos resultados deste estudo (Tabela 3 e Figura 1). Segundo Van Soest (1994), as fabáceas são digeridas à taxas mais elevadas e em menor extensão e as poáceas são degradadas à menores taxas e em maior extensão. Contudo, neste estudo, as taxas de degradação de poáceas e fabáceas não seguiram esse padrão (Tabelas 3). A menor extensão da degradação nas fabáceas pode ser explicado pela maior relação LDA/aFDNmo observada, apesar do tempo de incubação utilizado nesse estudo ser considerado curto (96 horas) para alcançar a fração indigestível verdadeira. A estimativa correta da fração indigestível () é um ponto crítico para a obtenção de melhor ajuste dos modelos, o que implica precisão e acurácia na estimação dos parâmetros cinéticos (Mertens, 1993). A verdadeira fração indigestível pode apenas ser alcançada após infinito tempo de fermentação anaeróbica e qualquer ponto final de fermentação possivelmente leva à superestimação da assíntota verdadeira (Mertens, 2005). Krizsan e Huhtanen (2013) observaram que o tamanho da fração indigestível dependia do ambiente ruminal no qual o alimento era incubado e concluíram que a fração indigestível não é uma característica intrínseca do alimento, pois é afetada pela dieta do animal. Entretanto, pode ser argumentado que a indigestibilidade intrínseca do alimento pode ser mensurada apenas sob condições fermentativas ótimas (in situ) que vão permitir a máxima extensão da degradação ou se o alimento for incubado in vitro (Mertens, 2005).Conclusões
Fabáceas apresentam maior fração indigestível que as poáceas.Gráficos e Tabelas