Perfil Lipídico dos Testículos e Ovários de Gatos, Após Suplementação com Ácido Docosahexaenoico (DHA)
2 - Universidade Estadual de Maringá
3 - Universidade Estadual de Maringá
4 - Universidade Estadual de Maringá
5 - Universidade Estadual de Maringá
6 - Universidade Estadual de Maringá
7 - Universidade Estadual de Maringá
8 - Universidade Estadual de Maringá
RESUMO -
Avaliou-se o efeito da suplementação com uma alga, rica em ácido docosahexaenoico (DHA), sobre a deposição e perfil lipídico do tecido reprodutivo de gatos machos e fêmeas. Trinta e sete animais receberam por 55 dias um alimento com níveis de 0,05%, 0,10%, 0,16% ou 0,21% de DHA, ou o controle que continha apenas gordura de aves, rica em ω-6. No final do experimento, os animais foram submetidos à castração cirúrgica e coletadas as gônadas. As amostras foram transesterificadas por catálise básica e ácida e lidas em cromatógrafo gasoso. Constatou-se o aumento da deposição do ω-3 nos órgãos reprodutivos, sendo a máxima deposição de 40,08 mg de DHA / 100 g de testículos e 30,25 mg de DHA / 100 g de ovários. Assim, foi ajustado o ponto de máximo acúmulo para os tratamentos 0,14% e 0,12% de DHA para machos e fêmeas, respectivamente. O DHA contido na dieta foi incorporado de forma efetiva nas gônadas, que passaram a apresentar menor relação ω-6:ω-3.
Lipid Profile of Testis and Cat Ovaries, After Supplementation with Docosahexaenoic Acid (DHA)
ABSTRACT - The effect of supplementation with a seaweed, rich in docosahexaenoic acid (DHA), on the deposition and lipid profile of the reproductive tissue of male and female cats was evaluated. Thirty-seven animals received a food with levels of 0.05%, 0.10%, 0.16% or 0.21% of DHA, or the control containing only ω-6 rich poultry fat, for 55 days. At the end of the experiment, the animals were submitted to surgical castration and the gonads were collected. The samples were transesterified by basic and acid catalysis and read in a gas chromatograph. The increase of the deposition of ω-3 in the reproductive organs was verified, being the maximum deposition of 40,08 mg of DHA / 100 g of testicles and 30,25 mg of DHA / 100 g of ovaries. Thus, the point of maximum accumulation was adjusted for the treatments 0.14% and 0.12% of DHA for males and females, respectively. The DHA contained in the diet was effectively incorporated into the gonads, which presented lower ω-6:ω-3 ratio.Introdução
O ácido docosaexaenoico (DHA), um ω-3, além de precursor de mediadores biológicos, também participa da neurogênese do sistema nervoso central e atua nas gônadas e células reprodutivas, entre outras funções (Ajmone-Cat et al., 2012). Este ácido graxo é acumulado no epidídimo sob ação de esteroides sexuais para então ser incorporado a membrana do espermatozoide (Caeser et al., 2010). O DHA favorece a motilidade, qualidade, concentração espermática e fusão com o oócito (Ollero et al., 2000). Já os ovários, tecidos lipídico-responsivos, podem sofrer modificações na síntese de prostaglandinas (PGs) devido a maior inclusão de ω-3 na dieta, favorecendo a síntese de PGE3, biologicamente menos inflamatória que a PGE2, esta podendo inibir a ovulação quando em níveis elevados (Broughton et al., 2010). Portanto, o objetivo deste trabalho foi avaliar o perfil lipídico dos testículos e ovários de gatos, após suplementação dietética de DHA proveniente da alga Schizotrichium spp.Revisão Bibliográfica
Os ω-3, ácidos graxos poli-insaturados (PUFA) como o DHA, desempenham papel importante na acilação de proteínas, precursores inflamatórios, ligante para transcrição de genes e atividade de β-oxidação, influenciando indiretamente as células reprodutivas (Caesar et al., 2010). Esteroides sexuais atuam na supressão mediada da lipogênese, fazendo com que os ácidos graxos da dieta sejam incorporados em órgãos específicos, como o fígado e epidídimo, nos testículos (Caesar et al., 2010). A PGE2 é sintetizada a partir dos ω-6 sendo necessária para induzir a inflamação folicular indispensável para a ovulação nas fêmeas, porém altos níveis a inibem. As dietas ocidentais são ricas em ω-6, o que traz prejuízos à ovulação. Ao aumentar a ingestão de ω-3, também há elevação da síntese de PGE3 nos ovários, que biologicamente tem ação mais tênue e concorre pelas mesmas vias de formação que a PGE2. A ovulação não é afetada pela baixa ingestão de DHA, mas consumo adequado do ω-3 promove um equilíbrio na fisiologia do ciclo ovulatório (Broughton et al., 2010). Nos machos, o DHA é responsável pela concentração e motilidade espermática, densidade e melhor formação das células. Os fosfolipídios da membrana têm alta concentração de DHA, que compõe 30% dos fosfolipídios ligados e 73% dos ácidos graxos poli-insaturados. Os espermatozoides aumentam a concentração plasmática de DHA ao caminhar dos túbulos seminíferos em direção ao epidídimo, mas sofrem menos oxidação que outras células graças à atuação de substâncias antioxidantes, como ascorbato e vitamina E, do superóxido dismutase e da glutationa (Yan et al., 2013).Materiais e Métodos
Foram utilizados 21 gatos machos e 16 fêmeas, pesando 3,58 ± 0,62 kg em média, com idade de 11,5 ± 0,5 meses. Os animais foram distribuídos em cinco grupos: controle (n = 9), o qual o alimento continha apenas gordura de aves com fonte lipídica (ω-6:ω-3 de 20:1), e quatro tratamentos com 0,05%, 0,10%, 0,16% ou 0,21% de DHA (n=7), proveniente de um produto comercial (a base da alga Schyzotrichium spp.), que substituiu a gordura de aves. As dietas foram fornecidas por 55 dias, quando então realizou-se a castração cirúrgica e coleta dos órgãos. Considerando à pequena quantidade de amostra, optou-se pelo pool dos testículos e ovários de cada tratamento, para determinar a deposição e o perfil lipídico das gônadas, através da transesterificação por catálise básica e ácida e cromatografia gasosa. O delineamento empregado foi em blocos casualizados (sexos), com estatística descritiva e análise de contrastes polinomiais para efeitos lineares ou quadráticos em função dos níveis de DHA empregados.Resultados e Discussão
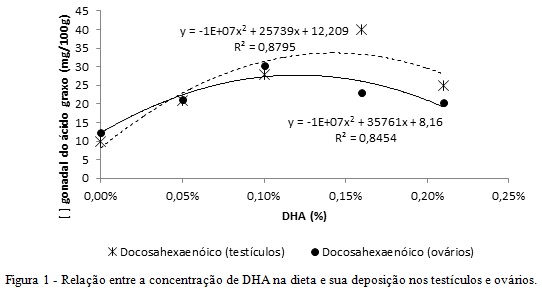
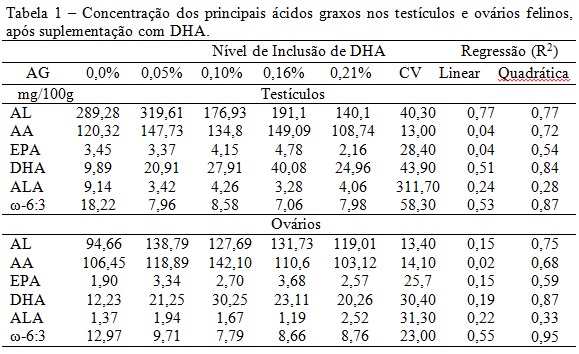
Podemos observar na tabela 1 que após suplementação com o ácido graxo, a deposição de DHA nas gônadas elevou-se. Nos testículos, a relação ω-6:ω-3 mais baixa foi de 7,06 com R2 de 0,87. Já nos ovários, essa relação foi estimada em 7,79, com R2 0,95. A deposição do DHA, em ambos os sexos, apresentou efeito quadrático e esses dados corroboram com o ponto de máximo acúmulo biológico do ω-3, sendo 40,08 mg de DHA/100 g de testículos e 30,25 mg de DHA/100 g de ovários. Tal ponto de máximo acúmulo foi ajustado para o tratamento com 0,14% de DHA para machos e 0,12% para fêmeas (figura 1). Há similaridade da resposta entre os sexos, porém as fêmeas parecem ser mais seletivas em incorporar o DHA, devido à rigorosa regulação dos ovários em incorporar PUFAs, de acordo com ciclos estrais, luminosidade, estação climática, quantidade e qualidade de folículos (Zeron et al., 2002). A incorporação do DHA nos testículos também visa o equilíbrio da relação ω-6:ω-3, através da “down regulation”, pois a deficiência de ω-6 em várias espécies, leva à atrofia testicular em até 10% do peso. Essa maior tolerância dos gatos machos em depositar DHA, pode estar relacionada à sua incorporação e funcionalidade no espermatozoide e ao metabolismo basal intenso do testículo (Igarashi et al., 2009).Conclusões
O DHA suplementado foi incorporado de forma efetiva nos testículos e ovários, diminuindo a relação ômegas-6:ômegas-3 nas gônadas, o que pode vir a influenciar a fisiologia dos órgãos e a qualidade dos gametas.Gráficos e Tabelas