
USO DE EUGENOL NO MANEJO DE PINTADO REAL (Pseudoplatystoma reticulatum x Leiarius marmoratus): RESPOSTA AO ESTRESSE
2 - Universidade Federal da Bahia
3 - Universidade Federal da Bahia
4 - Universidade Federal do Recôncavo da Bahia
5 - Universidade Federal da Bahia
6 - Universidade Federal da Bahia
RESUMO -
Este trabalho objetivou analisar a resposta ao estresse no manejo de pintado real (Pseudoplatystoma reticulatum x Leiarius marmoratus) com uso de eugenol como anestésico. Para a avaliação de estresse após o manejo, os peixes foram divididos em dois grupos: anestesiados com 50 µL L-1 de eugenol e não anestesiados. Foram avaliados os níveis de cortisol e glicose plasmáticos nos seguintes tempos: 0, 1 e 5 horas após o estresse de manejo (n=8). Ocorreu 25 e 50 % de mortalidade nos tempos 0 e 1 h após o manejo no grupo controle. Os níveis plasmáticos de cortisol foram significativamente maiores em exemplares não anestesiados no tempo de zero hora quando comparados a exemplares anestesiados com eugenol no mesmo tempo e exemplares não anestesiados 5 horas após o manejo (P <0,05). Os níveis de glicose plasmática não diferiram estatisticamente entre o grupo controle e o grupo anestesiado. Conclui-se que o uso de eugenol reduz o estresse de juvenis de pintado real imediatamente após o manejo.
USE OF EUGENOL IN HYBRID CATFISH (Pseudoplatystoma reticulatum x Leiarius marmoratus) MANAGEMENT: STRESS RESPONSE
ABSTRACT - This work aimed to analyze the response to stress in the handling of hybrid catfish (Pseudoplatystoma reticulatum x Leiarius marmoratus) with eugenol as an anesthetic. For stress evaluation after handling, the fish were divided into two groups: anesthetized with 50 μL L-1 of eugenol and non-anesthetized. Plasma cortisol and glucose levels were evaluated at the following times: 0, 1 and 5 hours after stress handling (n = 8). There were 25 and 50% mortality at 0 and 1 h after management in the control group. Plasma cortisol levels were significantly higher in non-anesthetized specimens at zero hour compared to specimens anesthetized with eugenol at the same time and non-anesthetized specimens 5 hours after handling (P <0,05). Plasma glucose levels did not differ statistically between the control group and the eugenol anesthetized group. It is concluded that the use of eugenol reduces the stress of hybrid catfish immediately after handling.Introdução
Práticas de manejo nos sistemas piscícolas como biometria e captura de exemplares são inevitáveis. Peixes submetidos a essas atividades podem apresentar consequências indesejáveis, como o comprometimento do sistema imunológico e do desempenho (ADAMANTE et al., 2008). E para restabelecer a homeostase, os peixes geram diversas respostas fisiológicas (INOUE & MORAES, 2007).
Para evitar o estresse, anestésicos têm sido utilizados durante o manejo. O eugenol é uma substância derivada do óleo de cravo, o qual é extraído das flores e caule do cravo-da-índia (MAZZAFERA, 2003). E com ampla utilização como anestésico natural em peixes (SILVA-SOUZA et al., 2015).
O pintado real é um hibrido desenvolvido recentemente no Brasil, resultado do cruzamento entre a fêmea Cachara Pseudoplatystoma reticulatum e o macho o jundiá amazônico Leiarius marmoratus. Considerando que não existem estudos com uso de anestésicos de pintado real (Pseudoplatystoma reticulatum x Leiarius marmoratus), este trabalho objetivou verificar a efetividade de eugenol na redução do estresse de manejo deste híbrido.
Revisão Bibliográfica
Há três níveis as respostas fisiológicas geradas por agentes estressores, sendo dividida em resposta ao estresse primária, secundária e terciária (BARTON, 1997). As respostas primárias são hormonais, havendo liberação de catecolaminas e corticosteroides. Já as respostas secundárias são mudanças nos parâmetros fisiológicos e bioquímicos causadas pelos efeitos destes hormônios no sangue ou a nível tecidual. Enquanto as respostas terciárias comprometem o desempenho, reprodução e o sistema imunológico (LIMA et al., 2006).
Neste sentido, o cortisol é utilizado como indicador de estresse primário em peixes, pois é o principal corticosteroide liberado em situação de estresse (MOMMSEN et al., 1999). Já a glicose é indicador do estresse de resposta secundária (WELLS & PANKHURST, 1999).Materiais e Métodos
Os procedimentos experimentais foram realizados na Universidade Federal do Recôncavo da Bahia (UFRB), Cruz das Almas - BA.
Para a avaliação de estresse durante o manejo, os peixes pesando em média 112,27g ± 6,19 e 25,06cm ± 0,43 de comprimento, foram divididos em dois grupos: anestesiados (24 peixes) e não anestesiados (grupo controle) (24 peixes). Os peixes do grupo anestesiados foram expostos a 50 µL L-1 de eugenol com 1–2 min de exposição em aquário de 4 L (um peixe por vez).
Após a indução anestésica, procedeu-se a biometria dos peixes (comprimento e peso), com exposição ao ar por 1 minuto. Posteriormente foi realizada coleta de sangue por punção caudal com seringa heparinizadas (tempo 0) de oito exemplares. Os 16 peixes restantes foram acondicionados em 2 tanques de 250 L (8 indivíduos/tanque), onde após 1 e 5 h da anestesia, foram realizadas as medidas biométricas com exposição ao ar por 1 minuto e posterior coleta de sangue. O grupo controle foi submetido aos mesmos procedimentos do grupo teste, contudo sem a exposição ao anestésico.
O sangue foi coletado e centrifugado para a obtenção do plasma. As amostras plasmáticas foram submetidas a refrigeração até serem encaminhadas para a realização das análises de cortisol e glicose, as quais ocorreram no Laboratório de Extensão em Análises Clínicas da UFBA.
Para determinação do cortisol, foi realizada através do Kit Vidas® Cortisol S, em teste de determinação quantitativa de cortisol em plasma a partir da técnica ELFA. Os níveis de glicose plasmática foram determinados pelo método enzimático a partir da glicose oxidase (GOD) / glicose peroxidase (POD).
A normalidade foi verificada por teste de Shapiro-Wilk. Os dados foram submetidos ao teste de Levene para verificar a homocedasticidade das variâncias. Os parâmetros cortisol e glicose foram analisados por análise de variância (ANOVA) de dois fatores. Existindo diferenças, foi realizado o teste post-hoc de Tukey com nível mínimo de significância de 95% (P < 0,05).
Resultados e Discussão
No grupo anestesiado não ocorreu nenhuma mortalidade, contudo no grupo não anestesiado foram registradas 25 e 50 % de mortalidade nos tempos 0 e 1 h após o estresse de manejo.
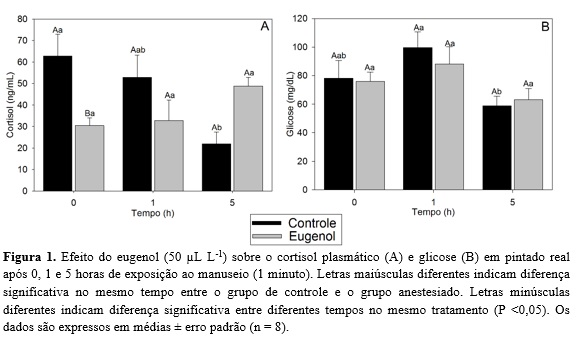
Os níveis plasmáticos de cortisol foram significativamente maiores em exemplares não anestesiados no tempo de zero hora quando comparados a exemplares anestesiados com eugenol no mesmo tempo e exemplares não anestesiados 5 horas após o manejo (P <0,05). Os níveis de glicose plasmática não diferiram estatisticamente (Figura 1a). Os níveis de glicose plasmática não diferiram estatisticamente entre o grupo controle e o grupo anestesiado com eugenol. Mas dentro do tratamento controle, a glicose plasmática foi significativamente maior no tempo 1 h quando comparada ao tempo 5 h (P <0,05) (Figura 1b).
A redução dos níveis de cortisol em peixes anestesiados com eugenol em comparação com o grupo não anestesiado também foi demostrado em jundiá (CUNHA et al., 2010). Esta redução dos níveis de cortisol pode ser explicada pela a indução do anestésico na transmissão de informações sensoriais a nível hipotalâmico, causando alterações hormonais que caracterizam o estresse (IVERSEN et al., 2003).
A elevação do nível de glicose no tempo 1 h em exemplares não anestesiados pode ser uma resposta fisiológica de adaptação frente a agentes estressantes, devido as catecolaminas e a gliconeogênese mediada por cortisol (PANKHURST, 2011), onde os níveis são reestabelecidos 5 horas após o estresse de manejo.
Conclusões
Conclui-se que o uso de 50 µL L-1 eugenol reduz o estresse de juvenis de pintado real imediatamente após o manejo por reduzir a mortalidade e o cortisol plasmático.
Gráficos e Tabelas
Referências
ADAMANTE, W.B. et al. Stress in Salminus brasiliensis fingerlings due to different densities and times of transportation. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, Belo Horizonte, v. 60, n. 3, p. 755-761, 2008.
BARTON, B.A. 1997. Stress in finfish: past, present and future – a historical perspective. In: Iwana, G.K.; Pickering, A.D.; Sumpter, J.P.; Schreck, C.B. (eds) Fish Stress and Health in Aquaculture. Society for Experimental Biology, Seminar Series 62, Cambridge: Cambridge University Press.
CUNHA, M. A. et al. Anesthesia of silver catfish with eugenol: time of induction, cortisol response and sensory analysis of fillet. Ciência rural, Santa Maria, v.40, n.10. p.2107-2114, 2010.
INOUE, L. A. K. A & MORAES, G. Óleo de Cravo: Um anestésico alternativo para o manejo de Peixes. Embrapa Amazônia Ocidental - Manaus, 24 p, 2007.
IVERSEN, M. et al. 2003. The efficacy of metomidate, clove oil, Aqui-Skand Benzoak as anaesthetics in Atlantic salmon (Salmo salarL.) smolts, and their potential stress-reducing capacity. Aquaculture 221, 549–566, 2003.
LIMA, L.C. et al. Stress in fishes. Rev Bras Reprod Anim, Belo Horizonte, v.30, n.3/4, p.113-117, 2006.
MAZZAFERA, P. Efeito alelopático do extrato alcoólico do cravo-da-índia e eugenol. Revista Brasileira de Botânica, v.26, p.231-238, 2003.
MOMMSEN, T. P.; VIJAYAN, M. M.; MOON, T. W. Cortisol in teleosts: dynamics, mechanisms of action, and metabolic regulation. Reviews in Fish Biology and Fisheries, v.9, p.211-268, 1999.
PANKHURST, N.W. The endocrinology of stress infish: an environmental perspective. Gen. Comp. Endocrinol, v.170, p. 265–275, 2011.
SILVA-SOUZA, J.G. et al. Eugenol como anestésico para oscar, Astronotus ocellatus. Arch. Zootec. v.64, p. 205-210, 2015.
WELLS, R. M. G.; PANKHURST, N. W. Evaluation of simpleinstruments for the measurement of blood glucose and lactate, and plasma protein a stress indicator in fish. Journal of the World Aquaculture Society, v.30, p.276-284, 1999.


